
题目列表(包括答案和解析)
3.下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境 ③乙醇是一种再生能源 ④燃烧时放出大量热量
A.①②③ B.①②④ C.①③④ D.②③④
2.人体血红蛋白中含有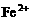 离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使
离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使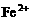 离子转变成
离子转变成 离子,生成高铁血红蛋白而丧失与
离子,生成高铁血红蛋白而丧失与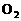 结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A.酸性 B.碱性 C.氧化性 D.还原性
1.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即制冷。该化学物质是( )
A.氯化钠 B.生石灰 C.固体氢氧化钠 D.固体硝酸铵
27.(8分)在100 mL 2 mol·L-1稀硫酸中加入0.1 mol的镁铝混合物,然后再滴加1 mol·L-1的NaOH溶液。请回答:
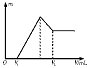 (1)若在滴加NaOH溶液过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160 mL时,金属粉末中n(Mg)= mol,V2= mL。
(1)若在滴加NaOH溶液过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160 mL时,金属粉末中n(Mg)= mol,V2= mL。
|
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol·L-1的硫酸溶解此混合物后,再加入450 mL 1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是 。
26.(6分)298 K时,向V L真空容器内通入了n mol SO2和m mol H2S。
(1)若n=2,当m= 时,反应后容器内气体密度最小。
(2)若2n>m,则反应后氧化产物与还原产物的差为 g。
(3)若5 n=m,且反应后氧化产物与还原产物的质量差为48 g,则n+m= 。
25.(10分)工业上可用甲苯生产对羟基苯甲酸乙酯 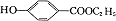
(一种常用的化妆品防霉剂),其生产过程如下图(反应条件未全部注明)所示:
(1)有机物A的结构简式为 。
(2)反应物的化学方程式(要注明反应条件)为: 。
(3)反应②的类型属 反应,反应④属于 反应。
(4)反应③的方程式(反应条件不要写,要配平)为: 。
(5)在合成路线中,设计第③步反应的目的是: 。

24.(6分)在某些酶的催化下,人体内葡萄糖的代谢有如下过程:
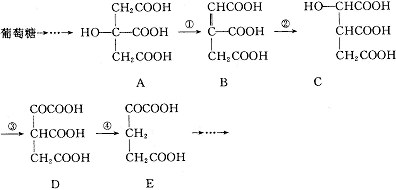
(1)过程①是 反应,过程②是 反应,过程③是 反应(填写反应类型名称)。
(2)过程④的另一种生成物是 (写化学式)
(3)上述物质中 和 互为同分异构体。
22.(10分)KClO3和浓盐酸在一定温度下反应会生成黄绿色易爆物二氧化氯,其表达式为: KClO3+ HCl(浓)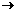 KCl+
ClO2↑+ Cl2↑+ .
KCl+
ClO2↑+ Cl2↑+ .
(1)请完成上述方程式(未知化学式及计量数填入框内)。
(2)浓盐酸在反应中显示出来的性质是:(填写编号) 。
①只有还原性 ②具有还原性与酸性 ③只有氧化性 ④具有氧化性和酸性
(3)产生0.1 mol Cl2,则转移电子物质的量为 mol。
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的 倍。
|
①O2==== 2O ②O2+O====O3 则
(1)写出以上①②反应的总方程式 。
(2)氧气与臭氧互称为 。
|
①CF2Cl2====Cl+CF2Cl;② ;③O+ClO====Cl+O2
写出以上②、③反应的净结果 。
上述反应过程中,Cl是 (填序号)。
A.反应物 B.生成物 C.中间产物 D.催化剂
21.(6分)为方便某些计算,常可将98%的浓硫酸表示为硫酸水合物形式(H2SO4·19H2O)或SO3水合物形式(SO3·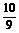 H2O),则98%的浓磷酸表示为磷酸水合物形式为
,表示为五氧化二磷水合物形式为
。
H2O),则98%的浓磷酸表示为磷酸水合物形式为
,表示为五氧化二磷水合物形式为
。
|
(1)试管乙中观察到的现象是 。
(2)加入浓硫酸的目的是 。
(3)该实验用到的球形管除冷凝作用外,另一重要作用是 。
(4)试管乙中饱和Na2CO3溶液的作用是 。
20.(12分)某课外活动小组模拟呼吸面具中原理(过氧化纳与潮湿的CO2反应),设计了用下列仪器来制取氧气并测量氧气的体积。
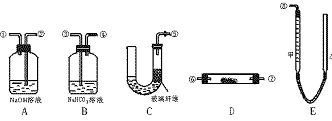
图4-2
图中量气装置E是由甲、乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50 mL);乙管可上下移动以调节液面高度。
实验室可供选择的药品还有:稀硫酸、盐酸、过氧化钠、大理石、水。试回答:
(1)上述装置的连接顺序是(填各接口编号,其中连接胶管及夹持用具均省略) 。
(2)装置C中放入的反应物是 。
(3)装置A的作用是 。装置B的作用是 。
(4)为了较准确地测量氧气体积,除必须检查各个装置气密性外,在读取反应前后甲管中液面高度,求其差值的过程中,应注意 和 。(填字母编号)
a.视线与凹液面最低处持平
b.等待片刻,待乙管中液面不再上升时立即读数
c.读数时应上下移动乙管,使甲、乙两管液面持平
d.读数时不一定使甲、乙两管液面持平
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com