
题目列表(包括答案和解析)
11、将Na2O2投入FeCl2溶液中,可观察到的现象是
A 生成白色沉淀 B 生成红褐色沉淀 C 有气泡产生 D 无变化
根据以下叙述回答12和13题
把0.6molX气体和0.2molY气体混合于2L容器中,使它们发生如下反应:3X(g)+Y(g)=nZ(g)+2w(g) 5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速度为0.01mol/L·min,则
10、某一元酸(HA)溶液,加入一种强碱(MOH)溶液,反应后溶液呈中性。下列判断正确的是
A 所用的酸过量 B 生成的盐不水解
C 酸与碱等物质的量混合 D 反应后溶液中[A-]=[M+]
9、下列反应的离子方程式正确的是
A 铁跟盐酸反应: 2Fe+6H+ =2Fe2++3H2↑
B 铜跟稀硝酸反应: 3Cu+8H++2NO3- =3Cu2++2NO↑+4H2O
C 铜跟氯化铁溶液反应:Cu+2Fe3+=Cu2++2Fe2+
D 碳酸钙跟醋酸:CaCO3+2H+ =Ca2++H2O+CO2↑
8、混合相同物质的量浓度的200mLBa(OH)2溶液和150mLNaHCO3溶液,最终所得溶液中各离子物质的量浓度大小顺序为
A [OH-]>[Ba2+]>[Na+]=[HCO32-] B [OH-]>[Ba2+]>[Na+]>[HCO32-]
C [OH-]>[Ba2+]>[Na+]>[CO32-] D [OH-]>[Na+] >[Ba2+]>[CO32-]
7、溴化碘的分子式为IBr,它的化学性质活泼,能跟大多数金属反应,也能跟某些非金属单质反应,它跟水反应的化学方程式为:H2O+IBr=HBr+HIO下列关于溴化碘的叙述中,不正确的是
A 固态IBr是分子晶体
B 把0.1mol/LIBr加入水中配成500mL溶液,所得溶液中Br‑和I-的物质的量浓度均为0.2mol/L
C IBr跟水的反应是一个氧化还原反应 D 在化学反应中,IBr可以作为氧化剂
6、微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是和,电解质溶液为,电极反应为:Zn+2OH--2e=ZnO+H2O Ag2O+H2O+2e=2Ag+2OH- 总反应为:Ag2O+Zn=2Ag+ZnO 根据上述反应式,判断下列叙述中,正确的是
A 在使用过程中,电池负极区溶液pH值减小
B 在使用过程中,电子由Ag2O极经外电路流向极
C Zn是负极,Ag2O是正极
D Zn电极发生还原反应,Ag2O电极发生氧化反应
5、下列溶液有时呈黄色,其中是由于久置时被空气中氧气氧化而变色的是
A 浓硝酸 B 硫酸亚铁 C 高锰酸钾 D 工业盐酸
4、已知氢化锂(LiH)属于离子晶体,LiH跟水反应可以放出氢气,下列叙述中正确的是
A LiH的水溶液呈中性 B LiH是一种强氧化剂
C LiH中的氢离子可以被还原成氢气 D LiH中氢离子与锂离子的核外电子排布相同
3、CH3COOH分别跟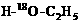 和
和 起酯化反应后,两者生成的水中所含
起酯化反应后,两者生成的水中所含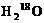 的质量分数
的质量分数
2、某强酸和某强碱溶液等体积混合后,所得溶液的pH值为7。原酸溶液和原碱溶液的物质的量浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com