
题目列表(包括答案和解析)
3.几种特殊试剂的存放
(1)钾、钙、钠在空气中极易氧化,遇水发生剧烈反应,应放在盛有煤油的广口瓶中以隔绝空气。
(2)白磷着火点低(40℃),在空气中能缓慢氧化而自燃,通常保存在冷水中。
(3)液溴有毒且易挥发,需盛放在磨口的细口瓶里,并加些水(水覆盖在液溴上面),起水封作用。
(4)碘易升华且具有强烈刺激性气味,盛放在磨口的广口瓶里。
(5)浓硝酸、硝酸银见光易分解,应保存在棕色瓶中,贮放在黑暗而且温度低的地方。
(6)氢氧化钠固体易潮解,应盛放在易于密封的干燥大口瓶中保存;其溶液盛放在无色细口瓶里,瓶口用橡皮塞塞紧,不能用玻璃塞。
2.液体药品的取用
取用很少量液体时可用胶头滴管吸取。取用较多量液体时可用直接倾注法:取用细口瓶里的药液时,先拿下瓶塞,倒放在桌上,然后拿起瓶子(标签应对着手心)瓶、口要紧挨着试管口,使液体缓缓地倒入试管。注意防止残留在瓶口的药液流下来,腐蚀标签。一般往大口容器或容量瓶、漏斗里倾注液体时,应用玻璃棒引流。
实验室里所用的药品,很多是易燃、易爆、有腐蚀性或有毒的。因此在使用时一定要严格遵照有关规定和操作规程,保证安全。不能用手接触药品,不要把鼻孔凑到容器口去闻药品(特别是气体)的气味,不得尝任何药品的味道。注意节约药品,严格按照实验规定的用量取用药品。如果没有说明用量,一般应按最少量取用:液体l~2mL,固体只需要盖满试管底部。实验剩余的药品既不能放回原瓶,也不要随意丢弃,更不要拿出实验室,要放人指定的容器内。
1.固体药品的取用
取用固体药品一般用药匙。往试管里装入固体粉末时,为避免药品沾在管口和管壁上,先使试管倾斜,把盛有药品的药匙(或用小纸条折叠成的纸槽)小心地送入试管底部,然后使试管直立起来,让药品全部落到底部。有些块状的药品可用镊子夹取。
3.计量仪器
(l)托盘天平 用于精密度要求不高的称量,能称准到0.1g。所附砝码是天平上称量时衡定物质质量的标准。
使用注意事项:①称量前天平要放平稳,游码放在刻度尺的零处,调节天平左、右的平衡螺母,使天平平衡。
②称量时把称量物放在左盘,砝码放在右盘。砝码要用镊子夹取,先加质量大的砝码,再加质量小的砝码。
③称量干燥的固体药品应放在在纸上称量。
④易潮解、有腐蚀性的药品(如氢氧化钠),必须放在玻璃器皿里称量。
⑤称量完毕后,应把砝码放回砝码盒中,把游码移回零处。
(2)量筒 用来量度液体体积,精确度不高。
使用注意事项:①不能加热和量取热的液体,不能作反应容器,不能在量筒里稀释溶液。
②量液时,量简必须放平,视线要跟量简内液体的凹液面的最低处保持水平,再读出液体体积。
(3)容量瓶 用于准确配制一定体积和一定浓度的溶液。使用前检查它是否漏水。用玻璃棒引流的方法将溶液转入容量瓶。
使用注意事项:①只能配制容量瓶上规定容积的溶液。
②容量瓶的容积是在20℃时标定的,转移到瓶中的溶液的温度应在20℃左右。
(4)滴定管 用于准确量取一定体积液体的仪器。带玻璃活塞的滴定管为酸式滴定管,带有内装玻璃球的橡皮管的滴定管为碱式滴定管。
 使用注意事项:①酸式、碱式滴定管不能混用。
使用注意事项:①酸式、碱式滴定管不能混用。
②25mL、50mL滴定管的估计读数为±0.01mL。
③装液前要用洗液、水依次冲洗干净,并要用待装的溶液润洗滴定管。
④调整液面时,应使滴管的尖嘴部分充满溶液,使液面保持在“0’或“0”以下的某一定刻度。读数时视线与管内液面的最凹点保持水平。
(5)量气装置 可用广口瓶与量筒组装而成。如图所示。排到量筒中水的体积,即是该温度、压强下所产生的气体的体积。适用于测量难溶于水的气体体积。
l.能加热的仪器
(l)试管 用来盛放少量药品、常温或加热情况下进行少量试剂反应的容器,可用于制取或收集少量气体。
使用注意事项:①可直接加热,用试管夹夹在距试管口 1/3处。
②放在试管内的液体,不加热时不超过试管容积的l/2,加热时不超过l/3。
③加热后不能骤冷,防止炸裂。
④加热时试管口不应对着任何人;给固体加热时,试管要横放,管口略向下倾斜。
(2)烧杯 用作配制溶液和较大量试剂的反应容器,在常温或加热时使用。
使用注意事项:①加热时应放置在石棉网上,使受热均匀。
②溶解物质用玻璃棒搅拌时,不能触及杯壁或杯底。
(3)烧瓶 用于试剂量较大而又有液体物质参加反应的容器,可分为圆底烧瓶、平底烧瓶和蒸馏烧瓶。它们都可用于装配气体发生装置。蒸馏烧瓶用于蒸馏以分离互溶的沸点不同的物质。
使用注意事项:①圆底烧瓶和蒸馏烧瓶可用于加热,加热时要垫石棉网,也可用于其他热浴(如水浴加热等)。
②液体加入量不要超过烧瓶容积的1/2。
(4)蒸发皿 用于蒸发液体或浓缩溶液。
使用注意事项:①可直接加热,但不能骤冷。
②盛液量不应超过蒸发皿容积的2/3。
③取、放蒸发皿应使用坩埚钳。
(5)坩埚 主要用于固体物质的高温灼烧。
使用注意事项:①把坩埚放在三脚架上的泥三角上直接加热。
②取、放坩埚时应用坩埚钳。
(6)酒精灯 化学实验时常用的加热热源。
使用注意事项:①酒精灯的灯芯要平整。
②添加酒精时,不超过酒精灯容积的2/3;酒精不少于l/4。
③绝对禁止向燃着的酒精灯里添加酒精,以免失火。
④绝对禁止用酒精灯引燃另一只酒精灯。
⑤用完酒精灯,必须用灯帽盖灭,不可用嘴去吹。
⑥不要碰倒酒精灯,万一洒出的酒精在桌上燃烧起来,应立即用湿布扑盖。
2.分离物质的仪器
(1)漏斗 分普通漏斗、长颈漏斗、分液漏斗。普通漏斗用于过滤或向小口容器转移液体。长颈漏斗用于气体发生装置中注入液体。分液漏斗用于分离密度不同且互不相溶的不同液体,也可用于向反应器中随时加液。也用于萃取分离。
(2)洗气瓶 中学一般用广口瓶、锥形瓶或大试管装配。洗气瓶内盛放的液体,用以洗涤气体,除去其中的水分或其他气体杂质。使用时要注意气体的流向,一般为“长进短出”。
24、(10分)将nmol木炭粉和1mol氧化亚铁在反应器中混合,隔绝空气加强热。
⑴可能发生的化学反应有
① Fe+C=Fe+CO↑ ② 2FeO+C=2Fe+CO2↑ ③FeO+CO=Fe+CO2↑
和 ④
⑵若n<1/4,充分反应后,反应器中的固体物质是 ,气体产物是 。
⑶若n<4,充分批应后,反应器中的固体物质是 ,气体产物是 。
⑷若反应的气体产物是混合物,n的取值范围是。
⑸若反应的气体产物是混合物,且混合物中CO和CO2的物质的量相等,则n的值为 。
23、 (8分)某烃B分子式是C1398H1278。它由4种基团组成,这4种基团分别是:
(8分)某烃B分子式是C1398H1278。它由4种基团组成,这4种基团分别是:
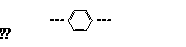
(3价) (2价) …C≡C… (2价) (CH3)3… (1价)
已知,该分子结构式中没有发现苯环连接苯环,也没有发现炔键;连接炔键的情况,试求分子中含有这4种基团各几个(请列式求解)
22、 (6分)结构中没有环状的烷烃又名开链烷烃。其分子式通式是CnH2n+2(n是正整数)。分子中每减少2个碳氢键,必然同时会增加1个碳碳键。它可能是重键(双键或三键)也可能是连结成环状烃,都称为增加了1个不饱和度(用希腊字母Ω表示,又名“缺氢指数”)。例如若干烃类分子和烃基的不饱度如下:
(6分)结构中没有环状的烷烃又名开链烷烃。其分子式通式是CnH2n+2(n是正整数)。分子中每减少2个碳氢键,必然同时会增加1个碳碳键。它可能是重键(双键或三键)也可能是连结成环状烃,都称为增加了1个不饱和度(用希腊字母Ω表示,又名“缺氢指数”)。例如若干烃类分子和烃基的不饱度如下:
① CH3CH2CH3
Ω=0;②(CH3)2CH- Ω=0;③CH2=CHCH2- Ω=1;④
CH3CH2CH3
Ω=0;②(CH3)2CH- Ω=0;③CH2=CHCH2- Ω=1;④
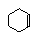
Ω=1;⑤C8H15- Ω=1;⑥ Ω=2;⑦ Ω=2;
⑧CH3C≡CCH2CH=CH2 Ω=3;

 ⑨CH3(CH=CH)3CH3 Ω=3;⑩ Ω=4;⑾
Ω=4;⑿C7H7- Ω=4。
⑨CH3(CH=CH)3CH3 Ω=3;⑩ Ω=4;⑾
Ω=4;⑿C7H7- Ω=4。
 ⑴请写出下列各烃分子的Ω
⑴请写出下列各烃分子的Ω

A B
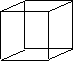 C
(立方烷,正立方体的每个顶点上有一个碳原子,每个碳原子上有一个
C
(立方烷,正立方体的每个顶点上有一个碳原子,每个碳原子上有一个
氢原子)
⑵请写出下列烃基的Ω
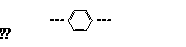
D (两价基团)Ω=

E (三价基团)Ω=
F …C≡C… (两价基团)Ω=
21、(10分)下面是3种有机物的结构式和名称(数字为碳原子编号):
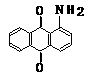


蒽 醌 1-氨基蒽醌(Ⅰ) 分散红 3B (Ⅱ)
用化合物(Ⅰ)为起始原料,经进3步主要反应可以得到化合物(Ⅱ)。

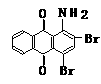
 (a)
+ Br2
→
+
(a)
+ Br2
→
+


(b)
+ H2SO4 +
↑
+
↑
红棕色
+ ↑

 无色
无色

 (c)
+
(c)
+
+ HBr
⑴请在以上3个化学方程式的方框内分别填入有关的化学式和化学式的化学计量数(即“系数”)。
⑵从第()步反应的化学原理看,它既发生了取代反应又发生了氧化还原反应。其中氧化剂是 ;配平后的化学方程式中共转移了 电子。
⑶请将反应式()箭号下面的改写在化学方程式的左端,重新另写出它的化学方程式 ,并配平之。
20、(6分)在某条件下,容器中有如下平衡反应:A+4B≒2C+D+热量 此时A,B,C,的物质的量均为amol,而D的物质的量为dmol。
⑴改变a的取值,再通过改变反应条件,可以使批评重新达到平衡,并限定达到新的平衡时,D的物质量只允许在d/2到2d这间变化,则a的取值范围应是 (用a和d的关系式表示)。
⑵如果要使本反应重新建立和平衡中,D的物质的量只允许在d到2d之间取值,则应该采取的措施是 (从下面列出的选项中选择)。
A 升高反应温度 B 增大反应容器内之压强 C 增大反应容器容积
D 降低批评温度 E 减小反应容器内之压强 F 减小反应容器容积
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com