
题目列表(包括答案和解析)
20、今有A、B、C、D四种元素。其中A元素为1826年法法国青年发现。他
在研究海水制盐时,于剩余的副产物苦卤中通入氯气后发现溶液颜色变深。若进
一步提取,可得一种红棕色液体,有刺鼻的臭味。B、C、D均为短周期元素。D
原子核内的质子数正好等于C原子核内质子数的两倍,而它们最外电子层上电子
数的2倍。则四种元素是:
A _______ B_______ C_______ D_______。
写出由上述元素组成的单质或化合物相互作用生成沉淀的二个反应方程式
(1)_________________________________________
(2)_________________________________________
19、在周期表中,同一主族元素化学性质相似,但是会发现有些元素的化学性
质和它在周期表中左上方和右下方的另一主族元素性质相似,如锂与镁,铍与铝
等 ,这称为对角线规则。请回答下列问题:
(1)锂在空气中燃,除生成 _______ 外,也生成微量的 _________。
(2)铍的最高氧化物的水化物的化学式是 ________ 属 ______化合物,证明这
一结论的有关离子方程式是 _________________________________。
(3)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则AL4C3遇强碱溶液反应
的离子方程式是 _______________________________。
17、常温下,将20.0g14%的NaCl溶液和30.0g24%的NaCl溶液混合,得到
密度为1.15g/cm3的混合溶液。
(1)该混合溶液的质量分数是 ______。
(2)该溶液的物质的量浓度是 ______mol/L。
(3)在1000g水中溶解______molNaCl才能使其浓度与上述混合溶液的浓
度相等。
|
18、向强碱性的热溶液中加入足量硫粉,发生反应生成S2-和 |
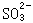 |
;生成物 |
|
继续跟硫粉作用生成 |
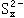 |
和 |
 |
。过滤后除去过量的硫,向滤液中加入一定 |
|
量的强碱后再通入足量的SO2,SO2跟 |
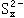 |
反应也完全转化为 |
 |
请回答: |
(1)写出以上各步反应的离子方程式
① ____________________________________,
② ____________________________________,
③ ____________________________________,
④ ____________________________________,
(2)若有amol硫经上述转化后,最终完全变为Na2S2O3,至少需SO2和NaOH
的物质的量分别是 ① ____________,② ____________。
(3)若原热碱液中含NaOH 6mol,则上述amol硫的转化过程里生成的 Na2Sx中
的X值为_______。
16、将一定温度下溶解度小于100g的某物质不饱和溶液分成甲、乙两份。甲份
的质量占1/5。已知甲乙两份之一蒸发掉 m克溶剂或另一份溶液中加入Mg溶质
完全溶解后都可成为该温度下的饱和溶液。则该物质在此温度下的溶解度为__
_______。
15、用 Na2SO3 和硫粉在水溶液中加热反应,可制得Na2S2O3。10℃和70℃
时,Na2S2O3在100g水中的溶液度分别为60.0g和212g。常温下,从溶液中析出
的晶体是Na2S2O3·5H2O。Na2S2O3在酸性溶液中立即完全分解:
Na2S2O3+2HCl = S↓+SO2↑+H2O+2NaCl
现取15.1Na2SO3溶于80.0mL水中。另取5.00g 1硫粉,用少许乙醇润湿后(以
便硫能被水浸润), 加到上述溶液中。用小火加热至微沸,反应约1小时后过
滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体。
(1)若加入的硫粉不用乙醇润湿,对反应的影响是______。(填写选项的字母)
A、会降低反应速度 B、需要提高反应温度
C、将增大反应体系析pH值 D、会减少产量
(2)反应1小时后过滤,其目的是 _______________。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质
是_________。它是由_______________而产生的。如果滤液中该杂质的含量不
很低,其检测的方法是_________________________________________________。
(4)设Na2SO3跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体
积约30mL,该溶液是否达到饱和?试通过计算说明。(70℃时,Na2S2O3饱和溶
液的密度为1.17g/cm3)。
(5)若要计算在100℃时将溶液蒸发至体积为30.0mL,再冷却至10℃时所能得
到的Na2S2O3·5H2O的质量,你认为 ______(填写一个选项的字母)
A、前面提供的数据已经足够
B、还需要提供100℃时溶液的密度(1.14g/cm3)
C还需要提供结晶后剩余溶液的体积(10.0mL)
(6)根据第(5)小题你的选择(如选A则直接计算,如选B或C则可选用其
数据),计算以10℃,30.0mL溶液中结晶出的Na2S2O3·5H2O的质量。
14、已知下列几个反应,判断还原剂中还原性从强到弱的顺序是
________________________________
(1)2H2SO3+O2=2H2SO4
(2)2Na2SO3+O2=2Na2SO4
|
|
(3) |
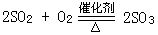 |
13、Na2SO3中有+4 价的硫, 它既有氧化性又有还原性。现有试剂:溴水、
硫化钠溶液、Na2SO3溶液、稀H2SO4、NaOH 溶液、氨水、稀HNO3。
(1)要证明Na2SO3具有还原性,应选用的试剂有______;现象是_____
_______________,反应的离子方程式是_____________________________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有 _____________; 现象
是__________________,反应的离子方程式是________________________。
12、配平下列化学方程式或离子方程式,并回答有关问题。
① _____ Fe3P+_____ HNO3 ─ _____ Fe(NO3)3+_____ H3PO4 +
_____ NO+ _____ __________
② 上述反应中,若有21mol电子转移时,生成是H3PO4是______mol,被还
原的硝酸是 _____ g。
③ 上述反应中,当生成1.8mol Fe3+时,放出NO的体积(标准状况下)
是 ________ L,消耗的HNO3是 _______ mol。
(2)① ____ P +____ CuSO4+ ____ H2O ─ ____ Cu3P+___ H3PO4
+____ H2SO4
②上述反应中,1molCuSO4氧化P的物质的量为 _______ mol。
(3) _______ KIx + ____ CL2 + ____ H2O ─ ____ KCl + ____HIO3
+ _______ _________
若KIx与CL2的系数比为1:8,则x值为 ______ 。
|
(4) _____ Clm+_____ OH- ─ _____Cl-+______ |
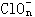 +______ +______ |
H2O
(5) _______ Na2Sx + ______ NaClO + _____ NaOH ─ _______
Na2SO4+ __________ NaCl+______ H2O
若 Na2Sx 在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试比
求得的x值写出该多硫化钠的化学式 _______ 。
(6) ____ KClO4 + _____ CrCl2 + ____ H2SO4 + ____H2O ─ _____
H2Cr2O7+_____ Cl2↑+_____ K2SO4
① 氧化剂是 _______ ,还原剂是 _______ ,氧化产物是 ____________;
② 若反应过程中,有0.5molCl2被还原出来,则有 ____molCrCl2发生了
反应,并有 _____mol 电子发生了转移。
|
(7) _______ |
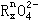 |
+_____________ |
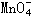 |
+_____________ H+ =__ |
_____RO2 + ______ Mn2++_________H2O
|
上述反应中,若0.2mol |
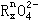 |
离子参加反应时共转移0.4mol电子。 |
① x值= ________ ;
② 参加反应的氢离子的物质的量为 _________ ;
③ 若RO2在常温下为气体,则R属于 _________ 族元素。
9、(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,请写出发生
反应的离子方程式:________________________________________。
(2)在以上中性溶液中,继续滴加 Ba(OH)2溶液, 请写出此反应的离
子方程式:___________________________。
|
10、在 |
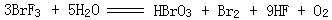 |
的反应中,每3mol的BrF3 |
中被水还原的BrF3的物质的量是 ________ 氧化产物与还原产物物质的量之比为_
__________。
|
11、在一定条件下, |
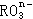 |
和 |
I- |
发生的离子方程式如下: |
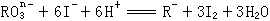
|
(1) |
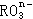 |
中R元素的化合价是 _________。 |
(2)R元素的原子最外层的电子数是 _________。
8、海水是提取溴的重要资源,从海水中提取溴的方法是:
(1)在 pH=3.5 的海水中通氯气将Br-转变为Br2;
(2)通空气将Br2从海水中吹出,并用Na2CO3溶液吸收;
(3)用硫酸酸化吸收有足量溴的碳酸钠溶液,使单质Br2分离析出。
写出上面每个步骤所发生反应的离子方程式。
① _______________________________________;
② _______________________________________;
③ _______________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com