
题目列表(包括答案和解析)
32、25℃时,将某强酸和某强碱溶液按1:10的体积比混合后溶液恰好呈中性,
则混合前此强酸与强碱溶液的pH值之和是_________
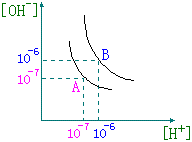
31、设水的电离平衡曲线如右下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃
时,水的电离平衡状态到B点,则此时水的离子积从_________增加到_________;
|
(2)将pH=8的Ba(OH)2溶液与 pH=5时的盐酸混合,并保持100℃的恒 温,欲使混合溶液pH=7,则Ba(OH)2与 盐酸的体积比为__________; (3)已知AnBm的离子积=[Am+]n [Bn-]m式中的[Am+]n和[Bn-]m表示 |
 |
离子的物质的量浓度。在某温度下,Ca(OH)2的溶解为0.74g,其饱和溶液密度
设为1g/cm3,其离子积为____________;
(4)若在室温下平均每n个水分子只有一个水分子发生电离,则n值是 __
__________;室温时10mL水中含有氢氧根离子约有___________个;
(5)常温时0.1mol/LHNO3和0.01mol/LHAc中水的电离度的关系是_____(填
>、<、=等符号);
(6)常温时pH值相同的HNO3和HAc中水的电离度的关系是_____;
(7)常温时0.3mol/L的H2SO4和0.6mol/L的NaOH中水的电离度的关系是____;
(8)pH=10的NaOH溶液与pH=10的NaCN溶液中水的电离度之比是_____;
(9)pH=4的HCl溶液与pH=4的NH4I溶液中水的电离度之比是______;
(10)pH=6的HCl溶液和pH=6的NH4Cl溶液,其中水电离出的[H+]分别
为xmol/L和 ymol/L,则x/y的比值为__________。
30、在一定温度下,冰醋酸加不稀释过程中,溶液的导电能力如右下图所示,
请回答:
|
(1)“O”点导电能力为0的理由是 ________________________________; (2)a、b、c三点溶液pH值由小到大 的顺序为_______________________; (3)a、b、c三点中电离度最大的是 ___________; |
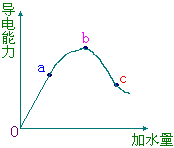 |
(4)若使C点溶液中[Ac-]增大,溶液的pH值也增大,可采取的措施是
①_________________;②________________;③_________________。
28、用0.1mol/LNaOH溶液做导电性实验, 然后逐渐滴加入等体积0.1mol/L
CH3COOH溶液,随着醋酸溶液的加入,电流计的读数会_______其原因是____
______________。
|
29、有一实验如右下图所示,将 30mL 0.1mol/LBa(OH)2溶液置于烧 杯中,然后边搅拌边慢慢加入 0.1mol/L由第3周期某元素形成的某 酸溶液25mL。加入酸溶液的体积V和 安培计的读数的坐标图如图(b) |
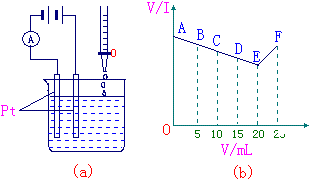 |
(1)此酸的化学式为_________;
(2)处于C点时,溶液中导电的阳离子主要是____________;
(3)处于F点时,溶液中导电的阴离子主要是___________;
(4)烧杯中刚加入酸时,观察到的现象是____________________;
(5)上图(b)中,从A→E电流强度I变小的主要原因是________________
_________________________。
27、在一定温度下,把4 molA气体和5 mol气体通入一个固定容积的密闭容器
|
中,发生以下反应: |
 |
当此反应进行到 |
一定程度时,反应混合物就处于化学平衡状态。 现在该容器中,维持温度不变,
令a、b、c、d 分别代表初始加入的A、B、C、D的物质的量,如果、取不同的数
值,它们必须满足一定关系,才能保证达到平衡时完全相同,请填写下列空白:
(1)a =0,b=0时,则c=_____, d=_____。
(2)若a=1,则c=_____,d=_____。
(3)a、b、c 取值必须满足的一般条件是(请用两个方程式表示,其中一
个只含a和c,另一个只含b和c)。
26、A、B两容器极易导热,A容器不变,B容器的活塞可上下滑动,保持内外
压强相等,在相同条件下,将等量的NO2 压入容积相同的A、B两容器中进行反
应: (用大于、小于、等于、增加、减小)回答下列问题:
(用大于、小于、等于、增加、减小)回答下列问题:
(1)反应起始时,两容器中生成N2O4的速率关系是______;
(2)反应达平衡时,两容器中生成N2O4的速率关系是______;
(3)反应达平衡后,NO2转化率大小关系是αA______αB;
(4)反应过程中____容器中反应先达平衡,在均达平衡后,分别向两容器
中充入等量的氩气,会造成平衡动的容器是____平衡移动后,NO2 转化率
将______;
(5)达平衡时两容器中分子总数nA______nB;
(6)达平衡时两容器中的压强PA______PB。
25、某温度时,在VL密闭容器中A、B、C三种物质的物质的量随时间的曲线如
右下图所示。由图中数据分析:
|
(1)该反应的化学方程式为 __________________; (2)求时间 t时B的转化率 __________________; (3)反应开始至ts,C的平均反应速率 __________________; |
 |
23、X、Y、Z三种常见的短周期元素,可以形成、等化合物。已知Y离子和
Z的离子有相同的电子层结构,X离子比Y离子多一个电子层。试回答:
(1)X离子的结构简图____________;
(2)写出工业上由XY2制取XY3的化学方程式____________________;
(3)Z2Y对应水化物的碱性比LiOH________;
(4)Z2Y2的电子式为____________,其中含有_______键和________键。
Z2Y2溶在水中的化学反应方程式__________________________;
(5)Z2X属于______晶体,它与水反应的离子方程式为:
__________________________。
|
24、可逆反应 |
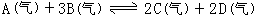 |
在四种不同情况下的反应 |
速率分别为:①VA=0.15mol/L·S ②VB=0.6mol/L·S ③VC=0.4mol/L·S
④VD=0.45mol/L·S,则该反应在不同条件下的反应速率最快的是______。(填
序号)
22、AxByCz是由A、B、C三种处于不同短周期的元素组成的化合物。已知:
(1)x、y、z均为正整数,且x+y+z=13。
(2)取0.05mol该化合物与过量的水反应,产生2.4g气体M,同时生成0.05
mol白色胶状沉淀R,且R既能溶于强酸又能溶于强碱。
(3)同温同压下,20mL由B、C两元素组成的M气体,完全燃烧时需40mL
O2,燃烧产物为CO2和H2O,通过分析判断可知3种元素分别是A、___
______、B______、C______,气体M的化学式是_______,该化合物的化学
式是 __________。
21、今有A、B、C、D四种短同期元素,它们的核电荷数依次增大。A与C、
B与D分别是同族元素。B、D 两元素的质子数之和是A、C两元素质子数之和
的两倍。这四种元素中有一种元素的单质易溶解于CS2溶剂中。则四种元素是:
A_______、 B_______、 C_______、 D________。
写出两种均含四种元素的化合物相互反应放出气体的化学方程式
____________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com