
题目列表(包括答案和解析)
1.将足量的氯气通入下列溶液中,溶液中溶质产生阴阳离子的结构都改变的是( )
A.AgNO3 B.Na2CO3 C.NaOH D.FeBr2
0.6mol 0.3mol
余nCl_=0.6-0.3=0.3(mol)
生成AgCl:0.3mol
假设HCl未被氧化:nAgCL=nHCl=0.6mol
故x的取值范围是:0.3<x<0.6
本题答案:C
例2.取一定量的MnO2和KClO3混合加热,反应完全后,将剩余的固体和浓盐酸混合加热,反应完全后将溶液蒸干,得固体质量与原混合物质量相等,求MnO2在原混合物中的质量分数。
解析:本题包含2个反应. 只有2个反应的固体质量改变相互抵消,方可使最后所得固体与原固体质量相等。该死题可采用差量法求解。
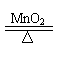 设原有固体混合物100g,其中MnO2的质量为xg,则含KClO3为(100-x)g.
设原有固体混合物100g,其中MnO2的质量为xg,则含KClO3为(100-x)g.
2KClO3 2KCl +3O2↑ △m固(减)
245
32×3 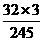 (100-x)
(100-x)
MnO2+4HCl Cl2↑+MnCl2+2H2O △m固(增)
87 39
x
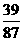 x
x
△m固(减)= △m固(增)
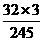 (100-x)=
(100-x)=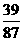 x
x
x= 46.6(g)
MnO2%=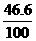 ×100=46.6%
×100=46.6%
例3.某澄清透明待测液中可能含有NH4+、Mg2+、Al3+、Fe2+、Cu2+、Br-、NO3-、SO42-等离子的一种或数种,进行下列实验:
根据实验结果:
(1)判断待测液中有无SO32-离子,并写出理由:
_____________________________________________________________。
(2)写出沉淀B的成分(要求说明B中肯定含有哪些物质?可能含有哪些物质?)
_____________________________________________________________。
(3)写出①、②、③各步反应的离子方程式:
①___________________________________________________________;
②________________________;③_______________________________。
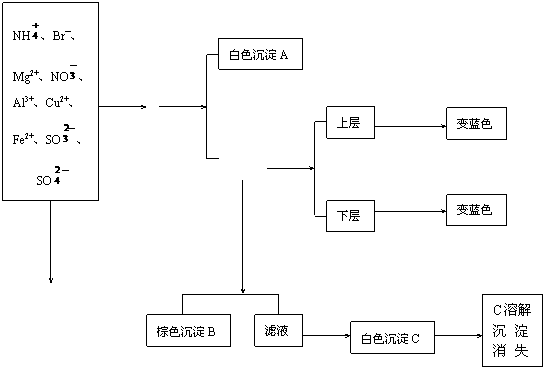
+Cl2 +BaCl2
适量 过滤 KI粉液
①
|
分层
KI淀粉液
过滤 ②
+H2S 加过量稀
NaOH溶液
无现象发生
+HCl +HCl
③
解析:判断有无SO32-,并不能根据原溶液通入H2S,无现象产生作出结论,因为SO32-与H2S并不反应,而应根据后面现象得知原溶液有Fe2+、Al3+,它们与SO32-要反应而不共,存。故待测液中无SO32-。因Cu2+与H2S要反应生成CuS(黑色),而Fe2+、Al3+、Mg2+、NH4与H2S均不反应,说明待测液中无Cu2+。
另根据过程①、②现象说明原溶液中会有Br-和Fe2+,它们分别被Cl2氧化成Br2和Fe3+进一步又把I-氧化成I2,使淀粉变蓝。
答:(1)原待测液无SO32-。因经分析原待测液中含有Fe2+、Al3+,它们与SO32-不共存。
(2)沉淀B中肯定有Fe(OH)3,可能有Mg(OH)2。
(3) ①Br2+2I-=I2+2Br-
②2Fe3++2I-=I2+2Fe2+
③AlO2-+H++H2O=Al(OH)3↓
巩 固 练 习
一选择题(每小题有1-2个正确答案)
例1.将0.2molMnO2和50mL 12mol/L盐酸混合缓慢加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为xmol(不考虑盐酸的挥发)
A.x=0.3 B.x<0.3 C.0.3<x<0.6 D.以上结论都不对
 解析 MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
解析 MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
1mol 4mol
0.2mol 0.6mol
若认为0.6mol HCl不足,按其完全反应求出产生的Cl2,后再继续求解,则一种错误的解法。原因是当盐酸稀到一定程度时,就不能再与MnO2反应生成Cl2,故x只能是一个范围。
假设HCl完全反应:
4HCl - Cl2 - 2Cl-(被氧化)
4mol 2mol
(五)溴水褪色情况种种
(1)物理变化--萃取
足量萃取剂CCl4或苯加入到少量溴水中,充分振荡、静置、分液,所得水层几乎无色。
思考 萃取剂必须具备什么条件?
提示 ①萃取剂与被萃取的物质(又称萃取质)不发生反应
②萃取剂能更好地溶解萃取质
③萃取剂与原溶剂互不相溶且密度差异大。
(2)化学变化使溴水褪色
①加成反应:烯、炔  卤代烃
卤代烃
②取代反应:苯酚  三溴苯酚
三溴苯酚
③歧化反应:强碱溶液。3Br2+6OH-=5Br-+BrO3-+3H2O
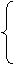 Mg或Zn粉:Mg+Br2=MgBr2
Mg或Zn粉:Mg+Br2=MgBr2
④还原反应 H2S: Br2+H2S=S↓+2HBr
SO2: Br2+SO2+H2O=2HBr+H2SO4
SO32-: Br2+SO32-+H2O=SO42-+2H++2Br-
想一想:溴水中加入适量的FeCl2或KI能使其褪色吗?
 提示:Br2+2Fe2+==2Br-+2 Fe3+ 棕
提示:Br2+2Fe2+==2Br-+2 Fe3+ 棕
黄
Br2 + 2I-== 2Br- + I2 色
结论:有反应发生,不一定能使溴水褪色,要注意生成物有无颜色。
(四)卤素单质不同溶剂中呈现的颜色
 X2
X2颜色 溶剂 |
Cl2 |
Br2 |
I2 |
|
水 |
淡黄绿色 |
橙色 |
棕黄色 |
 或CCl4 |
黄绿色 |
橙红色 |
紫红色 |
|
C2H5OH |
|
|
褐色 |
注意①溴或碘单质能否与加入溶剂溶为一体,取决于Br2或I2在这些溶剂中的溶解性如何。
②溴水或碘水中加入一种溶剂是否出现分层现象,取决于溶剂与水是否互不相溶。
③水溶液中加有溶剂若有分层现象,有色层上层还是下层,取决于有机溶剂与水的相对密度大小。记住
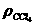 >ρ水>ρ汽油(或苯)
>ρ水>ρ汽油(或苯)
(四)卤素的相似性、递变性、特殊性
|
|
|
氟 |
氯 |
溴 |
碘 |
||||||
|
单 质 物 性 |
状态 熔、沸点 |
气 |
气(易液化) |
液(易挥发) |
固(易升华) |
||||||
 Mp. Bp.↗ |
|||||||||||
|
颜色 |
淡黄绿色 |
黄绿色 |
红棕色 |
紫黑色 |
|||||||
|
|
 颜色↗ 颜色↗ |
||||||||||
|
密度 |
 ρ↗ ρ↗ |
||||||||||
|
X2与H2O化合难易 |
条件 |
冷暗处 |
光照 |
加热 |
持续加热 |
||||||
 条件越高 |
|||||||||||
|
程度 |
剧烈爆炸 |
爆炸 |
缓慢 |
化合同时分解 |
|||||||
 剧烈程度越低 |
|||||||||||
|
X2与H2O反应剧烈程度 |
2F2+2H2O=4HF+O2 |
 X2+H2O HX+HXO(X-Cl.Br.I) X2+H2O HX+HXO(X-Cl.Br.I) |
|||||||||
|
剧烈 |
缓慢 |
微弱 |
极弱 |
||||||||
|
水溶性 |
与水反应生成HF酸 |
水中溶解性依次减小,有机溶剂中溶解性依次增大 |
|||||||||
|
与稀有气体反应 |
能,如生成XeF2、XeF4、XeF6、KrF2等 |
一般不与稀有气体反应 |
|||||||||
|
与淀粉显色反应 |
一般不反应 |
变蓝(I2特性) |
|||||||||
|
化合价 |
只有-1价、无正价 |
有-1、+1、+3、+5、+7等 |
|||||||||
|
含氧酸 |
无含氧酸 |
有HXO、HXO2、HXO3、HXO4等 |
|||||||||
|
卤化银 |
色 |
AgF(白) |
AgCl(白) |
AgBr(淡黄) |
AgI(黄色) |
||||||
|
水溶性 |
易溶 |
均难溶,且溶解度依次减小 |
|||||||||
|
感光性 |
难分解 |
 见水均易分解 见水均易分解感光性渐强 |
|||||||||
|
卤化钙(镁)水溶性 |
难溶 |
一般难溶 |
|||||||||
(三)Cl2的制法
1.实验室制法
(1)原理:强氧化性物质和盐酸反应
↓如
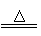 MnO2. KmnO4.
NaClO等
MnO2. KmnO4.
NaClO等
(2)反应:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
注意:稀HCl与MnO2不反应。
2KmnO4+16HCl ==== 2MnCl2+5Cl2↑+2KCl+8H2O
(3)制气装置
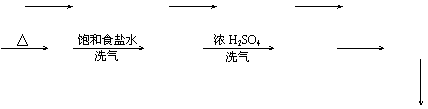 ①发生装置
②净化装置
③收集装置 ④尾气吸收
①发生装置
②净化装置
③收集装置 ④尾气吸收
固+液 气 除去HCl 除去H2O 向上排气集气法
尾气处理
NaOH溶液吸收
2.工业制法
 电解饱和食盐水(氯碱工业)
电解饱和食盐水(氯碱工业)
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
(二)氯化成分的多样性及其验证
1. 事实 结论

 观察
淡黄绿色
存在Cl3
观察
淡黄绿色
存在Cl3
KI一淀粉 变 蓝
|
NaCO3 有气泡 存在H+
AgNO3 有白色沉淀 存在Cl-
思考:为何无HCl分子?
2.原因分析
 Cl2 + H2O HCl +
HClO
Cl2 + H2O HCl +
HClO
 ‖
‖
H++Cl- H++ClO-
离子方程式为:
 Cl2 +
H2O H+ + Cl- + HClO
Cl2 +
H2O H+ + Cl- + HClO
2HClO 2HCl+O2↑
比较 新制氯水 久置(光照)氯水
分子 Cl2、HclO、H2O H2O
离子 H+、Cl-、ClO- H+、Cl-
想一想:
①新制氯水中H+、Cl-、ClO-离子浓度大小顺序如何?
②如何检验一瓶氯水是新制还是久置变质的?
③如何保存新制的氯水?
3. 影响氯水中Cl2+H2O H++Cl-+HclO的化学平衡
影响氯水中Cl2+H2O H++Cl-+HclO的化学平衡
加入物 成分浓度变化 平衡移动 应用
①可溶性氯化物 C(Cl-)↗ 左移 用饱和食盐水收集Cl2
或除去Cl2中的HCl
②酸 C(H+)↗ 左移 ClO-、Cl-、H+不共存
③碱 C(H+)↘ 右移 用NaOH吸收Cl2或用石灰乳制漂白粉
④光照 C(HClO)↘ 右移 氯水见光度质。
⑤NaHCO3 C(H+)↘ 右移 制高浓度HclO溶液
⑥NaHSO3 C(Cl2) ↘ 左移 使HClO浓度降低
(发生氯化-还原反应)
小结:HClO的性质
(1)弱酸性:HCl>H2CO3>HClO
漂白粉的漂白的原理:
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
或Ca(ClO)2+2HCl===CaCl2+2HClO
思考:漂白粉长期露置于空气中失效,原因是?变质后的成分是什么?
(2)强氧化性
(3)漂白性
(4)不稳定性
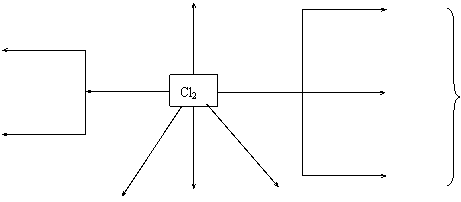
(一)Cl2的化学性质 HCl + O2
|
 HCl+HClO
Na
HCl+HClO
Na
点燃
HCl H2(纯) + H2O 高
|
苍白色火焰 与非金属反应 与金属反应 Fe 金
白雾 点燃 属
|
|
Cu 物
Fe3+ 点燃
Br2 Cl-+ClO-+H2O
或I2
小结:Cl2是一种很活泼的非金属单质,具有强氧化性,与金属、非金属反应时一般都作氧化剂,也可氧化许多较纸价具有还原性的物质。如Cl2+SO2+H2O==2HCl+H2SO4
Cl2+H2S==S↓+2HCl
Cl2+2HI==I2+2HCl
但在与水或碱的反应中,Cl2既作氧化剂又作还原剂,发生变化反应。与碱液反应,湿度不同,可能有不同的产物,如
常温:Cl2+2NaOH====NaCl+NaClO+H2O
加热:3Cl2+6NaOH====5NaCl+NaClO3+3H2O
注意:Cl-与ClO-(或ClO3-)在碱性条件下共存但在酸性条件下不共存。
 Cl- ClO-(或ClO3-) Cl-
ClO-(或ClO3-)
Cl- ClO-(或ClO3-) Cl-
ClO-(或ClO3-)
歧化 OH- 归化 H+
Cl2 Cl2
(三)计算
25.有一块金属钠投入到盛有100毫升氯化镁和氯化铝的混合注溶液的烧杯中,发现烧杯中沉淀先多后少,反应完毕后收集到标准状况下的氢气13.44升,同时得到21.4克沉淀,将些沉淀溶于过量苛性钠溶液中,发现沉淀减轻了15.6克。求原混合溶液中Mg2+、Al3+及Cl-的物质的量浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com