
题目列表(包括答案和解析)
22.(4分)能源问题是我国面临的重大课题。甲醇属于再生能源,发展前景非常乐观。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧热的热化学方程式________________________________________________。
(2)以甲醇为燃料可以设计甲醇燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液),电池反应与甲醇燃烧反应相似,其正极反应式为:3O2+12e-+6H2O=12OH- ,则负极反应式为_________。
21.(16分)下图是化学研究小组设计的铜与稀硝酸反应的两个实验装置图。其中装置Ⅰ为甲同学设计。(注:NaOH溶液可吸收NOx)
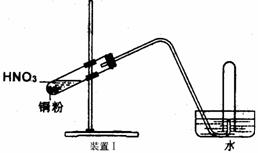

请回答下列问题:
(1) 如何检验该装置Ⅰ的气密性?_________________________________________________
__________________________________________________________________________。
(2) 铜与稀硝酸反应的离子方程式为_____________________________________。
(3) 乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由_________________________________________________。于是他设计装置Ⅱ。
(4) 化学研究小组的其它同学对上述实验进行了研究,认为装置Ⅱ虽然作了改进,但如果按装置Ⅱ进行实验,还是会出现三个问题,需要作相应改进措施。请你帮助他们填写相关内容。
问题一:_______________________________。
措施:加热或___________。
问题二:试管中的气体是淡棕红色,而不是无色。
措施:____________________________________________________________________(填具体操作。不能增加装置)。
问题三:________________________________________________________________。
措施:___________________________________________________________________。
20.(10分)现有下列仪器或用品:a.铁架台(含铁圈、铁夹) b.锥形瓶 c.滴定管 d.烧杯(若干) e.玻璃棒 f.胶头滴管 g.托盘天平(含砝码) h.滤纸 i.量筒 j.漏斗 k.温度计
现有下列试剂:A.NaOH固体 B.碳酸钠溶液 C.氯化镁溶液 D.蒸馏水
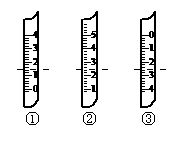 试填空:
试填空:
①如图分别是温度计、量筒、滴定管的一部分,
下述判断及读数(虚线刻度)不正确的是_______
A.①是量筒,读数为1.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.50mL
D.②是温度计,读数是2.5℃
②配制一定物质的量浓度的氢氧化钠溶液时,还缺少的仪器是 。
③除去Mg(OH)2中混有的少量Ca(OH)2:可以用的试剂是: (选填序号),操作方法是 、_______洗涤。完成③,上述仪器或用品用到的有___________(从上述仪器或用品中选择,并填上相应序号) 。
19.某溶液中仅含有Na+、H+、OH-、CH3COO-四种离子,下列说法不正确的是
A、溶液中的溶质不论是何种物质,四种离子一定满足:c(Na+)+ c(H+)=c(CH3COO-) + c(OH -)
B、溶液中四种离子之间不可能满足:c(Na+)>c(CH3COO-) > c(OH -)>c(H+)
C、当溶液中溶质为CH3COONa和NaOH时,则一定有c(Na+)>c(OH -)>c(CH3COO-)>c(H+)
D、当四种离子之间能满足c(CH3COO-)>c(Na+)> c(H+)> c(OH -)时,则溶液中溶质一定是CH3COONa和CH3COOH
18.一定温度下mg下列物质在足量的氧气中充分燃烧后,产物与足量的 Na2O2充分反应,过氧化钠增加了ng,且n>m,符合要求的物质是:
A、HCOOCH3 B、CH3CHO C、HOOCCOOH D、C6H12O6
17.恒温、恒压下,1 molA和nmolB在一个容积可变的容器中发生如下反应: A(g)+2B(g)  2C(g)。 一段时间后达到平衡,生成amolC。则下列说法中正确的是
2C(g)。 一段时间后达到平衡,生成amolC。则下列说法中正确的是
A.若起始时放入3molA和3nmolB,则达平衡时生成3amolC
B.起始时刻和达平衡后容器中的压强比为 (1∶1)
C.物质A、B的转化率之比为1:2
D.当v正(A)==2v逆(C)时,可断定反应应达平衡
16.下列有关化学实验的操作或说法中,正确的是
A、制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体。
B、制备Fe(OH)2时,将盛NaOH(aq)的滴管伸入到试管内FeSO4(aq)的液面下
C、焰色反应操作是:将铂丝放在稀盐酸中洗涤,然后蘸取待检物置于酒精灯或煤气灯的火焰上灼烧,观察火焰的颜色
D、用渗析法除去淀粉中混有的NaCl杂质
15.某一元弱酸HA的相对分子质量为M。在t℃时,将ag HA完全溶解于水,得V mL饱和溶液,测得该溶液的密度为ρg/cm3,其中n(A-)为b mol。下列叙述中,错误的是
A.溶液中c(H+)=[1000b+c(OH-)V]/V mol/L B.物质的量浓度c(HA)=(1000a/MV) mol/L
C.t℃时,HA的溶解度S=(100a/ρ)V g D.HA的质量分数ω(HA)=(a/ρV)×100%
14.某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
 下列说法中正确的是
下列说法中正确的是
A.t2时加入了催化剂
B.t3时降低了温度
C.t5时增大了压强
D.t4-t5时间内转化率最低
13.已知反应:①Cl2+2KBr=2KCl+Br2 ②KClO3+6HCl=3Cl2+KCl+3H2O
③ 2KBrO3+Cl2=Br2+2KClO3,下面说法正确的是
A.上述三个反应都有单质生成,所以都是置换反应
B.③中1mol Cl2反应,则氧化剂得电子的物质的量为2mol
C.反应②中还原剂与氧化剂的物质的量之比为5:1
D.氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com