
题目列表(包括答案和解析)
11、在常温下某化合物的水溶液中,已知由水电离出来的C(H+)和C(OH- )分别为amol/L
和bmol/L且a·b=10-28,下列离子组在该溶液中一定能大量共存的是( )
A、Al3+、NH4+、SO42-、Cl- B、Na+、K+、SO42-、SO32-
C、K+、Fe2+、Cl-、MnO4- D、Ba2+、Na+、Cl-、NO3-
10、已知在100℃时水的离子积常数为10-12,在100℃下,将pH=3的硫酸溶液和pH=10
的NaOH溶液相混合,若要使混合后溶液的pH=7,那么硫酸溶液和氢氧化钠溶液的
体积比约为( )
A、1:10 B、10:1 C、999:101 D、9:1
9、亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的是( )
A、0.1mol/L的亚硝酸溶液的pH值为2
B、100ml 1mol/L的亚硝酸恰好与100ml 1mol/L的 NaOH溶液完全反应
C、用HNO2溶液作导电实验,灯泡很暗
D、HNO2与NaCl不能发生反应
6、在一定温度下将amol PCl5通入一个容积不变的反应器中,达到如下平衡:
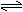 PCl5(g)
PCl3(g)+ Cl2(g),测得平衡后混合气的压强为P1,此时,再向反应器中通入amol PCl5,在不变的温度下再达到平衡,测得压强为P2,则P1和P2的关系是( )
PCl5(g)
PCl3(g)+ Cl2(g),测得平衡后混合气的压强为P1,此时,再向反应器中通入amol PCl5,在不变的温度下再达到平衡,测得压强为P2,则P1和P2的关系是( )
A、2P1>P2 B、2P1=P2 C、2P1<P2 D、P2>P1
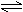 7、下列叙述表示可逆反应N2+3H2
2NH3,一定处于化学平衡状态的是( )
7、下列叙述表示可逆反应N2+3H2
2NH3,一定处于化学平衡状态的是( )
A、N2、H2、NH3 的百分含量相等
B、单位时间内,消耗a mol N2的同时消耗3a mol H2
C、单位时间内,消耗a mol N2的同时生成3a mol H2
D、反应若在定容的密闭容器中进行,温度一定时,压强不随时间改变
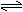 8、已知一定温度时,有反应:2SO2(g)+O2(g)
2SO3(g)+197KJ,在相同温度下,向密闭容器中通入2mol SO2和1mol O2,达到平衡时放出热量Q1,向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时,放出热量Q2,则下列关系式正确的是( )
8、已知一定温度时,有反应:2SO2(g)+O2(g)
2SO3(g)+197KJ,在相同温度下,向密闭容器中通入2mol SO2和1mol O2,达到平衡时放出热量Q1,向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时,放出热量Q2,则下列关系式正确的是( )
A、Q2=Q1/2 B、Q2<Q1/2 C、Q2>Q1/2 D、Q1=Q2
4、在空气中燃烧硫会有淡蓝色火焰和少量白烟,在氧气中燃烧硫有明亮的蓝紫色火焰,也有少量白烟,后者产生白烟的量(质量分数)比前者会( )
A、更多 B、更少 C、一样 D、无法判断
 5、已建立化学平衡的可逆反应A+B C ,改变条件,使化学平衡向正反应方向移动,下列叙述正确的是( )
5、已建立化学平衡的可逆反应A+B C ,改变条件,使化学平衡向正反应方向移动,下列叙述正确的是( )
A、生成物的质量分数一定增大 B、生成物的产量增加
C、反应物的转化率都增大 D、反应物的质量分数都降低
1、一般都能使反应速率加快的方法是( )
(1)升温 (2)改变生成物浓度 (3)增大反应物浓度 (4)减压
A、(1)(2)(3) B、(1)(3) C、(2)(3) D、(1)(2)(3)(4)
 2、在一密闭烧瓶中注入NO2 ,在25℃时建立下列平衡2NO2 N2O4+Q,若把烧瓶置于100℃的沸水中,下列情况:(1)颜色 (2)平均摩尔质量 (3)质量 (4)压强 (5)Q (6)密度,其中不变的是( )
2、在一密闭烧瓶中注入NO2 ,在25℃时建立下列平衡2NO2 N2O4+Q,若把烧瓶置于100℃的沸水中,下列情况:(1)颜色 (2)平均摩尔质量 (3)质量 (4)压强 (5)Q (6)密度,其中不变的是( )
A、(3)(6) B、(3)(4)(5) C、(2)(4) D、(1)(3)
 3、Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2+ +2H2O
Fe(OH)2+2H+,往该溶液中逐滴加入盐酸,发生的变化是( )
3、Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2+ +2H2O
Fe(OH)2+2H+,往该溶液中逐滴加入盐酸,发生的变化是( )
A、平衡向正方向移动 B、白色沉淀逐渐溶解
C、溶液颜色由浅绿色变为黄色 D、溶液颜色由浅绿变为深绿色
26.(10分)氯气和二氧化氮气体在室温下可以化合生成一种新的气态化合物A,为了测定A的组成进行以下实验,取Cl2、NO2混合气总体积5L,测定反应后所得气体体积随Cl2在原混合气体中所占体积分数x的变化而变化的规律。实验测知当Cl2所占体积分数为0.2或0.6 时,反应后的总体积均为4L。
(1)通过分析和计算求得化合物A的化学式为________,发生反应的化学方程式为________________
(2)试讨论当x(0<x<1) 的取值范围不同时,反应后总体积V随x变化的函数关系。将结果填入下表:
|
x值 |
V(反应后混合气体体积) |
|
|
|
|
|
|
|
|
|
25.(10分)CO和CO2都可以合成甲醇:CO + 2H2 -→ CH3OH ①
CO2 +3H2 -→ CH3OH +H2O ② CO、CO2和H2可通过下列反应制备:
Ⅰ.CH4 + H2O(g)-→ CO + 3H2 Ⅱ. CO + H2O(g)-→ CO2 + H2
反应Ⅰ的产物合成甲醇时H2过量,反应Ⅱ的产物合成甲醇时H2不足。为了充分利用原料可将两个反应的产物混合使用。
(1)反应I和反应Ⅱ的产物气体混合的最佳比例(用同温同压下气体体积比表示)
(2)若反应Ⅱ的CO由反应I提供,试通过计算说明,两个反应的产物气体无论怎样混合,都达不到最佳比例的要求。
24.(10分)①烷基苯在高锰酸钾的作用下,侧链被氧化成羧基,例如
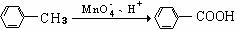
②酯类在铜铬氧化物(CuO••CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢解过程中不变,其反应原理如下:
RCOOR′+ 2H2
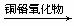 RCH2OH
+ HOR′
RCH2OH
+ HOR′
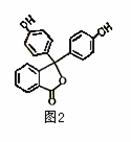 化合物A-E的转化关系如图1所示,已知:A是芳香化合物,只能生成3种一溴化合物,B有酸性,C是有机合成的重要中间体和常用化学试剂(C也可由其他原料催化氧化得到),D是一种常用的指示剂酚酞,结构如图2。
化合物A-E的转化关系如图1所示,已知:A是芳香化合物,只能生成3种一溴化合物,B有酸性,C是有机合成的重要中间体和常用化学试剂(C也可由其他原料催化氧化得到),D是一种常用的指示剂酚酞,结构如图2。

⑴D分子中的三个苯环 共平面(选填“能”或“不能”)。
⑵写出A、B、E的结构简式:
A. 、 B. 、 E. 。
⑶C与足量氢氧化钠溶液充分反应的化学方程式为 。
23.(8分)有机物A的化学式为C6H8O4Cl2,与有机物B、C、D、E的变化关系如下图:
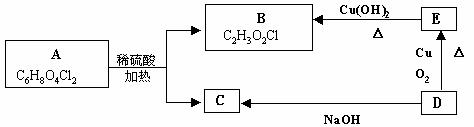
1molA经水解生成2molB和1molC,根据上述变化关系填空:
(1)写出物质的结构简式:A 、 B 、 C 、
D 、 E 。
(2)写出E转变为B的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com