
题目列表(包括答案和解析)
21、甲、乙两同学用一种标准盐酸去测定同一种未知浓度的NaOH溶液的浓度,但操作不同,甲把一定体积的NaOH溶液放入锥形瓶,把标准盐酸放入滴定管进行滴定,乙把一定体积的标准盐酸放入锥形瓶,把未知浓度NaOH溶液放入滴定管进行滴定。
(1)甲使用的是 滴定管,乙使用的是 滴定管。
(2)若甲同学使用的滴定管用蒸馏水洗净后未润洗,其余操作均正确,这样甲测定的结果
偏 。
(3)若乙同学在滴定至终点时,仰视滴定管读数,其余操作均正确,这样乙测定的结果偏
。
20、 在100℃和2×105Pa的条件下,反应aA(g) dD(g)+ eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变),下表列出了不同压强下反应建立平衡时物质D的浓度。
在100℃和2×105Pa的条件下,反应aA(g) dD(g)+ eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变),下表列出了不同压强下反应建立平衡时物质D的浓度。
|
压强/Pa |
2×105 |
5×105 |
1×106 |
|
D的浓度/mol·L-1 |
0.085 |
0.20 |
0.44 |
根据表中数据,回答下列问题:
(1)压强从2×105Pa增加到5×105Pa时,平衡向 反应方向移动(填正,逆),
理由是 。
(2)压强从5×105Pa增加到1×106Pa时,平衡向 反应方向移动(填正,逆),
理由是 。平衡之所以向该方向移动,这是
由于 。
19、
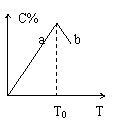 对于可逆反应2A+B 2C在反应过程中C的百分含量随温度变化如图则:
对于可逆反应2A+B 2C在反应过程中C的百分含量随温度变化如图则:
(1)T0对应的V(正)与V(逆)的关系是
(2)正反应为 热反应
(3)a、b两点正反应速率的大小关系是
(4)温度T<T0时,C%逐渐增大的原因是
18、怎样用最简单的方法除去混在KNO3溶液中的少量Fe3+
17、电工操作中规定,不能把铜线和铝线拧在一起连接线路,这是因为 。
16、在盛有水的电解槽中加入等物质的量的Ag+、Pb2+、Na+、SO42-、NO3-、Cl- 摇匀后
用惰性电极进行电解,通电片刻后,氧化产物与还原产物的质量比为( )
A、8:1 B、16:207 C、35.5:108 D、435:648
15、用石墨作电极电解3mol/L KCl和0.5mol/L Al2(SO4)3的混合溶液时,下列电解变化
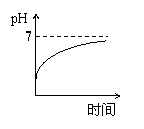
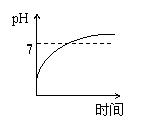

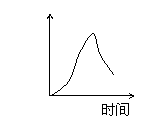

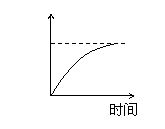 的曲线合理的是( )
的曲线合理的是( )
A、 B、 C、 D、
14、25℃时CuSO4的溶解度是25g,如在该温度下将50gCuSO4放入100g水中,充分搅拌溶解后,所得溶液的质量是( )
A、125g B、115g C、105g D、84g
13、 已知在NaH2PO4溶液中存在着下列平衡体系:H2O H+ +OH-、H2PO4-+H2O
已知在NaH2PO4溶液中存在着下列平衡体系:H2O H+ +OH-、H2PO4-+H2O
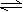
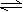
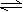 H3PO4+OH-、H2PO4- H+ +HPO42-、HPO42- H+ +PO43-……下列关系式正确的是( )
H3PO4+OH-、H2PO4- H+ +HPO42-、HPO42- H+ +PO43-……下列关系式正确的是( )
A、2[OH-] =[H+]
B、[H2PO4-] +[HPO42-]+[PO43- ]+[H3PO4] =[Na+]
C、[Na+] +[H+]=[OH- ]+[H2PO4-] +[HPO42-]+[PO43-]
D、[Na+] +[H+]=[H2PO4- ]+[OH-] +2[HPO42-]+3[PO43-]
12、镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是氢氧化钾,放电时的电极
反应是:Cd+2OH--2e=Cd(OH)2 ;2NiO(OH)+2H2O+2e=2Ni(OH)2+2OH-,下列说
法不正确的是( )
A、电池充电时,镉元素被还原 B、电池充电时,电池的正极和电源的正极连接
C、电池放电时,电池负极周围溶液的pH不断增大
D、电池的总反应是Cd+2NiO(OH)+2H2O=Cd(OH)2+2NiO(OH)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com