
题目列表(包括答案和解析)
19.(9分)有失去标签的乙醇和乙醛两瓶液体,请根据下列提供的试剂用两种化学方法来鉴别它们。将选用试剂序号(a、b、c、d),实验条件(Ⅰ、Ⅱ)以及实验现象和化学方程式填入表格内。
选用试剂:
a. 质量分数为2%的AgNO3溶液和2%的氨水
b. 质量分数为10%的AgNO3溶液和10%的氨水
c. 质量分数为10%的NaOH溶液和2%的CuSO4溶液
d. 质量分数为2%的NaOH溶液和10%的CuSO4溶液
实验条件:
Ⅰ. 热水浴
Ⅱ. 加热至沸
|
|
选用试剂 |
实验现象 |
化学方程式 |
|
1 |
|
|
|
|
2 |
|
|
|
18.质量分数不等的两种硫酸钠溶液等质量混合时,其质量分数为a %,而等体积混合后的质量分数为b %;质量分数不等的两种乙醇溶液等质量混合时,其质量分数为a %,,而等体积混合后的质量分数为c %。则a、b、c的大小关系正确的是( )
A.a>b>c B. b>a>c C. c>a>b D. c>a>b
第Ⅱ卷 (非选择题 共76分)
17.某化工厂工业废水中含H2SO4的质量分数为1%,采用边排放边中和的方法将它处理使之基本呈中性,处理方法如图所示。若处理后废水pH=7,则1%NaOH溶液的流量为( )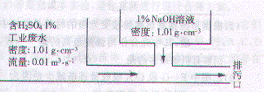
A.0.00816 m3·s-1 B. 0.01 m3·s-1
C.0.01632 m3·s-1 D.0.02 m3·s-1
16. 可变的密闭容器中盛有适量的N2、H2混和气体,在一定条件下反应:N2+3H2 2NH3达到平衡时容器容积为VL,混合气体中NH3占体积20%,若压强、温度保持不变,下列推论不正确的是( )
可变的密闭容器中盛有适量的N2、H2混和气体,在一定条件下反应:N2+3H2 2NH3达到平衡时容器容积为VL,混合气体中NH3占体积20%,若压强、温度保持不变,下列推论不正确的是( )
A.原N2、H2混合气体为100VL
B.参加反应的N2为0.1VL
C.原N2、H2混合气体为1.2VL
D.原混合气体中N2、H2体积比为1∶3
15. NCl3的电子式为  ,则NCl3和H2O反应时,最初的生成物一定有( )
,则NCl3和H2O反应时,最初的生成物一定有( )
A.NH3 B.HNO2 C.HClO D.NH4Cl
14. 酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,下列说法正确的是( )
 A.HB-水解方程式:HB-+H2O H3O++B2-
A.HB-水解方程式:HB-+H2O H3O++B2-
B.溶液中离子浓度大小为:c (Na+)>c(HB-)>c(OH-)>c(H+)
C.NaHB的存在抑制了水的电离
D.相同物质的量浓度溶液的pH值:Na2B>NaHB
13. 用1kg溶剂中所含溶质的物质的量表示的溶液的浓度叫质量物质的量浓度,其单位是mol/kg。某物质的溶液的质量分数为1.96%,质量物质的量浓度为0.2mol/kg,则该物质可断为( )
A.NaHCO3 B.CaCO3 C.KHCO3 D.Na2CO3
12. 用NA表示阿伏加德罗常数,则下列说法错误的是( )
A.1molCH5+所含的电子数为10NA
B.1molC20H42中含有61NA个共价键
C.25℃时1mL纯水中含有10-10NA个OH-离子
D.22.4L的NH3中含有4NA个原子
11. 在天平的左右两边各放一个烧杯,加入足量盐酸并使天平保持平衡,向左边烧杯中加入14.4gMg,向右边烧杯中加入14.4gAl,此时天平不再平衡,下述操作可使天平恢复平衡的是( )
A. 右边加0.45g Al
B.左边加0.98g Mg
C. 左边加14.4gMg, 右边加15.3g Al
D. 左边加14.4gMg, 右边加14.85g Al
10. 对于反应 4NH3(g)+5O2(g)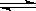 4NO(g)+6H2O(g) (正反应为放热反应),下列有关叙述正确的是( )
4NO(g)+6H2O(g) (正反应为放热反应),下列有关叙述正确的是( )
A.若降低温度,达到新的化学平衡时,NO的体积分数将增大
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.对NH3与O2的反应来说,化学反应速率关系是2υ(NH3)=3υ(H2O)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com