
题目列表(包括答案和解析)
1.下列物质一定不是天然高分子的是
A 橡胶 B 蛋白质 C 尼龙 D 纤维素
26.(12分)为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的 S O2及(NH4)2SO4和NH4HSO4固体。
为测定上述(NH4)2SO4和NH4HSO4固体棍合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃,测得有关数据如下(标准状况):
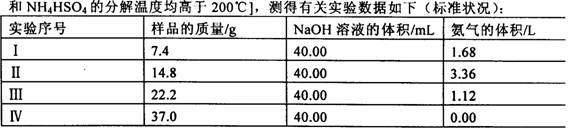
(1)测定过程中有关反应的离子方程式为__________。
(2)由I组数据直接推测:标准状况下3.7g样品进行同样实验时生成氨气的体积为_____。
(3)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___。
(4)欲计算该NaOH溶液的物质的量浓度应选择第_____组数据,理由是_____。并由此计算NaOH溶液的物质的量浓度,写出计算过程。
25. (8分)某校研究性学习课外环保监测小组对采集气体样品中所含污染气CO的浓度进行测定,其方法与步骤如下:
a.首先使采集的气体样品2.00L缓缓通过I2O5的加热管,发生反应:
5CO+ I2O5==5C O2+I2 :
b.将产生的I2升华,并由浓度为0.005mol/L的Na2S2O3溶液30.0mL完全吸收,此时发生反应I2+2 Na2S2O3==2NaI+ Na2S4O6 ;
c.向b的溶液中加4滴淀粉溶液作指示剂,用浓度为0.01 mol/L的I2水滴定,耗去5.00mL的溶液恰好变色。
(1)操作c中,滴定终点时溶液由_____色变为_____色
(2)步骤a中由CO与I2O5反应生成I2的物质的量是多少?
③该气体样品中CO的浓度为多少mg/L?
24.(10分)已知有以下两种类反应:
①羧酸的钠盐与碱石灰共热,可以发生脱去羧基的反应:
RCOONa+NaOH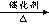 RH+Na2CO3
RH+Na2CO3
②两个醛分子在一定条件下可以自身加成。下式中反应的中间产物(III)可看成是由(I)中的碳氧双键打开,分别跟(II)中的2一位碳原子和2一位氢原子相连而得。(III)不稳定,受热即脱水而生成不饱和醛(烯醛):’
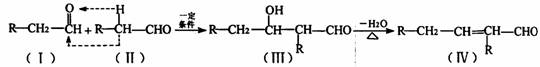
有机物A的分子式为C14H 12O2在一定条件下,按照下列框图进行反应。其中C完全燃烧生成CO2和水的物质的量比为2:1,且C不能使酸性高锰酸钾溶液褪色。

请回答下列问题:
(1)写出有机物A的结构简式____,其名称是_________。
(2)有机物A∽H中,属于芳香烃的是______。
(3)写出下列反应的化学方程式:B→C______;E→F___:F→G_______。
23.((8分)有机玻璃(结构简式如右图)是由有机物X 加聚制得的热塑性塑料。为透明如玻璃状的无色固体,可用以制造航空玻璃、仪表盘、外科照明灯、装饰品和生活用品等。请回答下列问题:
(1)写出X的结构简式_____________;
(2)在下列反应中,有机物X不能发生的反应有______(填写序号);
①和氢气加成;②使溴水褪色:③被酸性高锰酸钾溶液氧化;④水解反应;⑤酯化反应;⑥消去反应。
(3)有机物X有多种同分异构体,其中含有2个甲基、且属于不饱和梭酸类的有机物分子的结构简式为_______________。
22.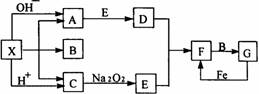 (12分)右图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据右图关系推断:
(12分)右图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据右图关系推断:
(1)化学式:X___,A___,B___。
(2)实验室收集气体D和F的方法依次是_____法、_____法。
(3)写出C→E的化学反应方程式___________________。
(4)请写出A与E反应生成D的化学方程式:__________。
 五、(本大题包括2小题,共18分)
五、(本大题包括2小题,共18分)
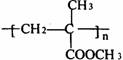
21.(6分)已知A, B, C, D四种不同粒子。他们之间存在如右图关系:
(1)如果A、B、C、D均为10电子的粒子,则A的结构式为________;D的电子式为_______。
(2)如果A为一种金属阳离子,且A、B、D均为10电子粒子,C为30电子粒子。试写出:A和B在溶液中反应生成C和D的离子方程式。_______。
20.(12分)为了验证铜与稀硝酸反应产生的是一氧化氮,某校学生实验小组设计了一个实验,其装置如右图所示(加热装置和固定装置均己略去)。B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离.设计此步操作的目的是______。.
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为__________________。
(3)装置E中开始时出现浅红棕色气体,原因是________;用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,原因是_________。
(4)如果要用第(1)步操作产生的CO2将E中的空气排得更干净,在不增加其它仪器的情况下,应怎样改进E?_____________。
(5)一段时间后,C中白色沉淀溶解,其原因是____________。
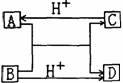 (6)装置D的作用是____________。
(6)装置D的作用是____________。
19.(10分)50mL0.5mol/L的盐酸与50mL0.55mol/L的
NaOH溶液在下图所示的装置中进行中和反应。通过测定
反应过程中所放出的热量可计算中和热。请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__
;由图可知该装置有不妥之处,应如何改止?________。
(2)烧杯间填满碎塑料泡沫的作用是_________。
(3)大烧杯上如不盖硬纸板,则求得的中和热数值____(填“偏大”、“偏小’、“无影响”)。
(4)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”),理由是_________;所求中和热的数值会_______(填“相等”或“不相等”),理由是______。
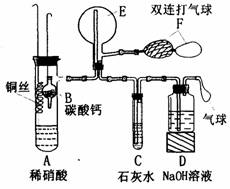 (5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会____(填“偏大,,、“偏小”、“无影响”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会____(填“偏大,,、“偏小”、“无影响”)。
18.NaCl晶体中最小重复单元(晶胞)如右图所示。已知:氯化钠的摩尔质量为M g/mol,某一定条件一下NaCl晶体中最邻近的钠离子和氯离子中心间的距离为a cm,晶体的密度为b g/cm3。则下列叙述正确的是
A.每个Na+周围最近且等距离的Cl一所围成的空间构型为正六面体
B.每个Na+周围最近且等距离的Cl一所围成的空间构型为正八面体
C.阿伏加德罗常数NA可表示为M/2a3b
D.阿伏加德罗常数NA可表示为4M/a3b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com