
题目列表(包括答案和解析)
7、下列性质的递变规律正确的是( )A. Na、Mg、Al的还原性依次减弱 B. HCl、PH3、H2S的稳定性依次减弱C.S2-、Cl-、Ca2+ 的离子半径依次减小 D. C、N、O、F 的原子半径依次增大
6、若原子序数为 116 号元素, 其元素最外层电子数为 6, 则下列叙述正确的是( )
A. X 是金属元素 B. X的钠盐的化学式为: Na2X
C. X的最高价氧化物的化学式为: XO3 D. X的最高价氧化物的水化物为强酸
5、X、Y、Z和R分别代表四种元素. 如果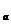 Xm+、
Xm+、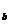 Yn+、
Yn+、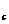 Zn-、
Zn-、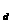 Rm- 四种离子的电子层结构相同(a、b、c、d为元素的原子序数), 则下列关系正确的是( )
Rm- 四种离子的电子层结构相同(a、b、c、d为元素的原子序数), 则下列关系正确的是( )
A. a – c = m + n B. a – b = n – m C. c – d = m + n D. a + d = c + b
4、写出下列反应的方程式:
(1) F2和水的反应: (7) H2S和氯水的反应:
(2) Cu和S的反应:
(3) Fe和S的反应: (8)氢硫酸的电离:
(4) 铁CL2的反应:
(5) S和NaOH溶液的反应: (9)O2变成O3:
(6) 标况下H2S22·4L和含有氢氧化钠1mol的溶液 反应 :
(10): 标况下100L的H2S和100L的O2充分反应:
3、比较S和CL2的氧化性: 强,原因是: 。比较S和O2 的氧化性顺序:
强,原因是: 。
2、用电子式表示下列物质的形成过程:
Na2O MgCL2 NH3 H2S
1、氧族元素包括: 。随着原子序数的递增,原子半径: 金属性 非金属性: 。H2S、HF、H2O、H2Se稳定性顺序是: 还原性顺序是: 。
1、(20分)
将Na2SO3与Na2S的混合物若干克配制成50g溶液, 加入50g一定浓度足量的盐酸,放出气体0.448L(标准状况),混合液为96.9g。求混合物中Na2SO3与Na2S的物质的量各为多少?
翰林汇
练习 第六章 氧族元素
2、(13分)
下面是A、B两种盐所进行的实验记录,其中H、G均为不溶于酸的白色沉淀:
由此推知A、B以及实验过程中产生的C、D、E、F、G、H各是什么物质(用化学式表示)。
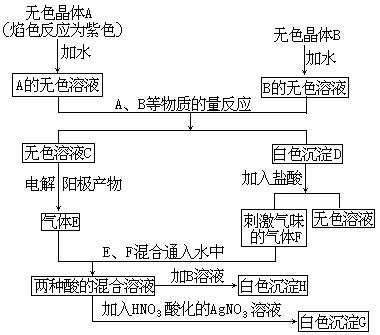
A 、B 、C 、D 、E 、F 、G
H 。
翰林汇
1、(13分)
只用BaCl2溶液和试管,鉴别Na2SO3溶液和稀H2SO4,简述鉴别步骤、现象和结论。(上述3种溶液只准取用一次)
翰林汇
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com