
题目列表(包括答案和解析)
1.纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如,将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是( )
A.常温下,“纳米铜”比铜片的金属性强
B.常温下,“纳米铜”比铜片更易失电子
C.常温下,“纳米铜”与铜片的还原性相同
D.常温下,“纳米铜”比铜片的氧化性强
31.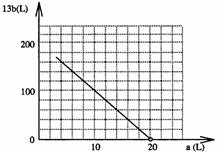 (1)308
(1)308
(2)52
(3)设SO2为X(体积分数),则有
4×(11×X/8+0.0800)=1-0.0800-X
X=0.0923
(4)①13b=200-10a
②
(2003全国理综8)某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成份是
A HCl和CO B HCl、H2和CO C CH4和NH3 D HCl、CO和CO2
(03春全国理综8)下列说法正确的是 ( )
A.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
B.只有非金属能形成含氧酸或含氧酸盐
C.除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性
(2003广东1)水资源非常重要,联合国确定2003年为国际淡水年。下列关于水的说法中错误的是 ( )
A 蒸馏法是海水淡化的方法之一
B 淡水的密度小于海水的密度
C 融化的雪水中矿物质含量比深井水中的少
D 0℃以上,温度越高,水的密度越小
(2004江苏4)下列关于浓硫酸的叙述正确的是 ( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
(2004江苏5)向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是 ( )
A.碳酸氢钠溶液中滴加稀盐酸
B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液
D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
27.(本题共12分)
(1)3H2S+2Fe(OH)3→Fe2S3+6H2O(2分) (2)27n(3分)
(3)b(3分) (4)生产纯碱(或作制冷剂等,其它合理答案也给分)(2分)
(5)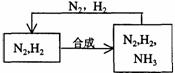 (2分)
(2分)
(2002上海31).硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3
设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00mol FeS2完全氧化,需要空气的体积(标准状况)为 L
 (2)55L空气和足量FeS2完全反应后,气体体积(同温同压)变为 L
(2)55L空气和足量FeS2完全反应后,气体体积(同温同压)变为 L
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2氧化产生的气体混合物为100L,其中O2为aL,SO2为bL。
① 写出a和b的关系式
② 在右图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)
说明:为方便作图,纵坐标用13b表示
27.(12分)有三种质量比可能相同或不同的镁铝合金样品①、②、③。小明、小青、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究。
(1)小明取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为_______________________。(2分)
(2)小青取样品②m2 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则m3的取值范围是___________________。(2分)
(3)小红取不同质量的样品③分别和30mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
|
实验序号 |
a |
b |
c |
|
合金质量(mg) |
510 |
765 |
918 |
|
气体体积(mL) |
560 |
672 |
672 |
求:(ⅰ)盐酸的物质的量浓度;(2分)
(ⅱ)合金中镁的质量分数;(2分)
(ⅲ)在c组实验后,还需向容器中加入1.0mol/L的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?(2分)
26.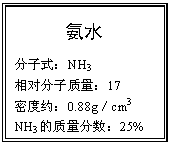 (6分)右图为某市售氨水试剂标签上的部分数据。问:
(6分)右图为某市售氨水试剂标签上的部分数据。问:
⑴在标准状况下,1体积水吸收多少体积的NH3气体可制得上述氨水。(水的密度:1.00g/cm3)
⑵将该试剂10mL与70mL2mol·L-1的AlCl3溶液混合,生成的沉淀质量为a g,求a的值。(2分)
25.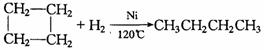 (10分)(11分)已知:环丙烷、环丁烷、环戊烷在催化剂作用和加热条件下都可以与氢气发生类似应,如环丁烷与氢气反应如下:
(10分)(11分)已知:环丙烷、环丁烷、环戊烷在催化剂作用和加热条件下都可以与氢气发生类似应,如环丁烷与氢气反应如下:
而碳原子数不大于4的环烷烃可与卤素、卤化氢发生上述类似反应,而碳原子数大于4的环烃与卤素则发生取代反应。
试填空:
(1)环丁烷经过_______、________(填反应类型) 即得到1,3-丁二烯(CH2==CH-CH==CH2)。
(2)已知二甲苯充分加氢后得烃A,A再与溴发生取代反应,产物之一为B;B的相对分子质量比A大158;烃C分子的一取代物只有两种。一定条件下它们可发生下述转化:
① 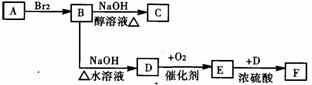 写出有关物质的结构简式:
写出有关物质的结构简式:
A ;C 。
② 写出反应的化学方程式:
B→D ;E→F 。
24.(10分)使用有机材料制成的薄膜,给环境造成的“白色污染”后果十分严重。我国最近研制成功的一种可降解塑料结构如下:
|
|
|
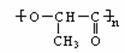
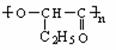
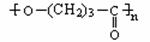
该塑料有良好的生物适应性和分解性,能自然腐烂分解。试回答下列问题:
(1)这种可降解塑料的A、B、C链节所对应的三种单体依次是___、____、_____。
(2)可降解塑料在自然界可通过______(填反应类型)反应分解为三种单体小分子有机物。
(3)A的单体和C的单体各1mol在浓H2SO4存在、加热条件下,可生成含有八元环的环状化合物,写出有关反应的化学方程式为________。
(4)B的单体在浓H2SO4中可发生消去反应生成不饱和酸,此不饱和酸的结构简式是________。此不饱和酸属于链状酸的同分异构体还有___种。
23.(15分)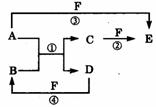 A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出)。
A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出)。
(1) 若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,③与④两个反应中都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式是__________。
(2) 若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F、所含元素同周期,则,反应①的化学方程式是_________; B固体属于____晶体,E固体与B固体比较,______熔点高(填“B”或“E”)。
(3) 若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则C的结构式为________反应①和③的化学方程式分别是__________、_______________。
22.(4分)能源问题是我国面临的重大课题。甲醇属于再生能源,发展前景非常乐观。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧热的热化学方程式________________________________________________。
(2)以甲醇为燃料可以设计甲醇燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液),电池反应与甲醇燃烧反应相似,其正极反应式为:3O2+12e-+6H2O=12OH- ,则负极反应式为_________。
21.(16分)下图是化学研究小组设计的铜与稀硝酸反应的两个实验装置图。其中装置Ⅰ为甲同学设计。(注:NaOH溶液可吸收NOx)
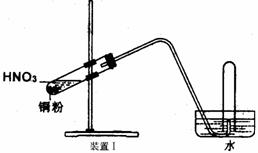
请回答下列问题:
(1) 如何检验该装置Ⅰ的气密性?_________________________________________________
__________________________________________________________________________。
(2) 铜与稀硝酸反应的离子方程式为_____________________________________。
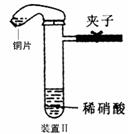
(3) 乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由_________________________________________________。于是他设计装置Ⅱ。
(4) 化学研究小组的其它同学对上述实验进行了研究,认为装置Ⅱ虽然作了改进,但如果按装置Ⅱ进行实验,还是会出现三个问题,需要作相应改进措施。请你帮助他们填写相关内容。
问题一:_______________________________。
措施:加热或___________。
问题二:试管中的气体是淡棕红色,而不是无色。
措施:____________________________________________________________________(填具体操作。不能增加装置)。
问题三:________________________________________________________________。
措施:___________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com