
题目列表(包括答案和解析)
(六)构、位、性的相互关系

 性 质
性 质
位同化学性质同
位近化学性质近 主族最外层电子数=最高正价(除O、F)
左→右 递变性 核电荷数和核外电子数决定电子得失能力

 上→下 递变性、相似性
上→下 递变性、相似性

 原子序数=质子数=核电荷数
原子序数=质子数=核电荷数

 位 置
主族序数=最外层电子数
结 构
位 置
主族序数=最外层电子数
结 构
周期序数=电子层数
(五)性质递变规律:
(1) 同周期元素递变性:
(2)
Na Mg Al
 与冷水反应:
剧烈 缓慢
与冷水反应:
剧烈 缓慢
 与热水反应: 更剧烈
明显且溶液呈碱性
与热水反应: 更剧烈
明显且溶液呈碱性
与H+(酸溶液)反应: 很剧烈 剧烈 较为缓和
Mg(OH)2 Al(OH)3
与酸(H+)反应: 可溶(Mg(OH)2+2H+=Mg2++2H2O) 可溶(Al(OH)3+3H+=Al3++3H2O)
与碱(OH-)反应: 不溶 可溶(Al(OH)3+OH-=AlO2-+2H2O)
Si P S Cl
与H2化合条件 高温下,很少部分化合 高温 加热 光照或点燃
氢化物稳定性 极不稳定 不稳定 较不稳定 稳定
最高氧化物 SiO2 P2O5 SO3 Cl2O7
及其水化物 H4SiO4 H3PO4 H2SO4 HClO4
酸性 弱酸 中强酸 强酸 最强的酸(水溶液中)
结论: Na Mg Al Si P S Cl
 金属性逐渐减弱, 非金属性逐渐增强
金属性逐渐减弱, 非金属性逐渐增强
(2)同主族元素递变性:
:
 族 ⅠA ⅡA ⅢA ⅣA ⅤA
ⅥA ⅦA O
族 ⅠA ⅡA ⅢA ⅣA ⅤA
ⅥA ⅦA O
周期 非金属性逐渐增强
|

|
 1 金
非 稀
1 金
非 稀
|
|
|
|
|
 3 性
属 气
3 性
属 气
|
|
|
|
|
 5 渐
逐 元
5 渐
逐 元
6 增 渐 素
 7 强
金属性逐渐增强
增
7 强
金属性逐渐增强
增
强
小结:元素周期表中同周期,则主族元素性质的递变规律
|
项 目 |
同周期(从左到右) |
同主族(从上到下) |
|
价电子数 (最外层电子数) |
由1逐渐增到7 |
相同 |
|
主要化合价 |
最高正价由 +1→+7 负价由 -4→-1 |
最高正价相同 |
|
原子半径 |
逐渐减小(惰性气体除外) |
逐渐增大 |
|
金属性与非金属性 |
金属性减弱 非金属性增强 |
金属性增强 非金属性减弱 |
|
最高价氧化物对应水化物的酸碱性 |
碱性减弱 酸性增强 |
碱性增强 酸性减弱 |
|
非金属的气态氢 化物 |
生成由难到易 稳定性由弱到强 |
生成由易到难 稳定性由强到弱 |
|
得失电子能力 |
失电子由 大→小 得电子由 小→大 |
得电子由 大→小 失电子由 小→大 |
(四).元素周期表的结构:
(1)周期:具有相同电子层的一系列元素列为一个周期:
周期序数=原子核外电子层数
(2)族:具有相同最外层电子数(主族)或价电子数(副族)的一系列元素称为一族.
|
第一周期 (2种)
 三个短周期—— 第二周期(8种)
第三周期(8种)
七个周期
第四周期(18种)
(七个横行) 三个长周期—— 第五周期(18种)
三个短周期—— 第二周期(8种)
第三周期(8种)
七个周期
第四周期(18种)
(七个横行) 三个长周期—— 第五周期(18种)
 第六周期(32种)
一个不完全周期 第七周期(21种)
七个主族(ⅠA
- ⅦA)
十六个族—— 七个副族(ⅠB -- ⅦB)
(十八个纵行) 一个八族(Ⅷ)(含3个纵行)
第六周期(32种)
一个不完全周期 第七周期(21种)
七个主族(ⅠA
- ⅦA)
十六个族—— 七个副族(ⅠB -- ⅦB)
(十八个纵行) 一个八族(Ⅷ)(含3个纵行)
一个零族(稀有气体)
主族元素:由长、短周期元素组成的族.
主族序数=最外层电子数=元素最高正化合价
(非金属元素:8-|负化合价|).
或 (非金属元素: 最高正化价+|负化合价| = 8
零族元素:
原子最外层电子已达稳定结构,故稀有气体在通常情况下难以发生化学反应:但与F2可在一定条件下反应,生成如XeF4等化合物,所以其惰性是相对的。
副族元素:全部由长周期元素组成的族.
副族序数=价电子数=最高正化合价
价电子:用来参与化学反应的最外层电子以及次外层或倒数第三层的部分电子.
(三)核外电子的排布规律
|
 电子由内向外按能量由低到高分层排布
电子由内向外按能量由低到高分层排布
 |
|||
|
|||
注意电子层的表示方法
|
电子层数(n) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
符号 |
K |
L |
M |
N |
O |
P |
Q |
|
能量大小 |
K<L<M<N<O<P<Q |
(一)原子结构
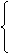 质子 Z个
质子 Z个
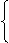 原子核
原子核
原子(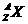 )
中子 (A-Z)个
)
中子 (A-Z)个
核外电子 Z个
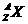 的含义:代表一个质量数为A,质子数为Z的原子
的含义:代表一个质量数为A,质子数为Z的原子
质量数(A)=质子数(Z)+中子数(N)
核电荷数=质子数=核外电子数
|
|
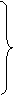 ① 电子的质量极小(9.1095×10-31 kg)
① 电子的质量极小(9.1095×10-31 kg)


② 电子运动速度极大(接近光速) ④ 电子运动无确定轨道

③ 电子运动空间极小(直径约为10-10m)


64、前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克组成。u夸克带电量为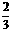 e,d夸克带电量
e,d夸克带电量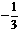 e,e为基元电荷。下列论断可能正确的是
e,e为基元电荷。下列论断可能正确的是
A 质子由1个u夸克和及1个d夸克组成,中子由1个u夸克和2个d夸克组成
B 质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成
C 质子由1个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成
D 质子由2个u夸克
63、合价为n的某元素的硝酸盐的式量为x,其氢氧化物的式量为y,则n的值是
A 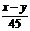 B
B 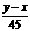 C
C 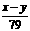 D
D 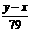
62、)两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有
A 1对 B 2对 C 3对 D 4对
61、以下说法正确的是
A 纳米材料是指一种称为“纳米”的新物质制成的材料
B 绿色食品是指不含任何化学物质的食品
C 生物固氮是指植物通过叶面直接吸收空气中的氮气
D 光导纤维是以二氧化硅为主要原料制成的
60、某元素X最高价含氧酸的分子量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是
A X的最高价含氧酸的分子式可表示为H3XO4
B X是第二周期VA族元素
C X是第二周VIA族元素
D X的最高化合价为+4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com