
题目列表(包括答案和解析)
(四)新型无机非金属材料
特性:(1)耐高温,高强度
(2)有电学、光学、生物学特性或功能
(三)硅酸盐工业简介
|
|
水泥 |
玻璃(普通) |
|
原料 |
石灰石、粘土 |
纯碱、石灰石、石英 |
|
设备 |
迴转窑 |
 玻璃熔炉 玻璃熔炉 |
|
反应 |
复杂的物理化学变化 |
 Na2CO3+SiO2 Na2SiO3+CO2↑ Na2CO3+SiO2 Na2SiO3+CO2↑CaCO3+SiO2 CaSiO3+CO2↑ |
|
主要成分 |
3CaO·SiO2 2CaO· SiO2 3CaO·Al2O3 |
Na2O·CaO· 6SiO2 |
|
特性 |
水硬性 (加石膏调节硬化速度) |
玻璃态物质 (在一定温度范围内软化) 非晶体 |
陶瓷:
(1)主要原料:粘土
(2)生产过程:混合→成型→干燥→烧结→冷却→陶器
(3)陶与瓷的制取区别: ①原料粘土的纯度不同
②烧制温度不同。
(二)典型构质的性质
1. 单质碳
C原子间结合方式
单质碳
C原子间结合方式
(1)同素异形体的多样性
分子中所含C原子数不同
金刚石--原子晶体
 原子晶体
原子晶体
石墨--混合晶体
分子晶体
(2)活性炭的重要性质和作用
↓
多孔疏松结构→吸附力强→吸附气体或溶液里的某些有色物质。
↓实例
①去臭气--吸附水中有臭味物质(净化水)
②漂白--吸附某些食物和工业产品中的色素
③去毒--吸附有毒气体(如NO2、Cl2等)(用于防毒面具)
(3)碳的化学性质
常温:稳定
加热、高温或点燃:常表现还原性,作还原剂
一般加热时,C → CO2
 高温时,C → CO
高温时,C → CO
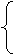 如: C+H2O CO+H2
如: C+H2O CO+H2

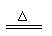 2C+SiO2 2CO+Si
2C+SiO2 2CO+Si
 C+2CuO 2Cu + CO2
C+2CuO 2Cu + CO2
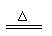
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
想一想:为什么木炭燃烧时无火焰?
2.碳的氧化物
CO、CO2尽管用为碳的氧化物,但是两者的物理性质,化学性质均有较大区别,可列表比较如下:
|
|
CO |
CO2 |
|
物理性质 |
无色无气味气体难溶于水 |
无色略带酸味气体能溶于水(1 :1) |
|
毒性 |
有毒(与血红蛋白结合) |
无毒(大量排放会导致温室效应) |
|
化学性质 |
①可燃性 ②还原性 ③不与碱液反应 |
①一般不可燃烧,也不支持燃烧但Mg、Li能在CO2中燃烧 ②弱氧化性 ②弱氧化性 2Mg+CO2 C+2MgO 2Mg+CO2 C+2MgOC+CO2 2CO ③与碱液反应 |
|
类别 |
不成盐氧化物 |
酸性氧化物 |
|
检验 |
点燃后在火焰 上方罩上干燥的 烧杯和用清石  灰水润洗过的烧杯 灰水润洗过的烧杯 |
能使清石灰水变浊但不能使品红褪色(有别于SO2) |
|
实验室制法 |
HCOOH
CO↑+H2O |
CaCO3+2HCl==CaCl2+CO2↑+H2O |
|
工业制法 |
 水煤气法: 水煤气法:C+H2O CO+H2 |
 煅烧石灰石法: 煅烧石灰石法:CaCO3 CaO+CO2↑ |
思考下列小问题:
①如何除去CO中少量CO2?
②如何除去CO2中少量CO?
③如何分离CO和CO2?
3.比较CO2和SiO2
CO2和SiO2是同主族元素形成的高价氧化物。化学性质有一定的相似性,但物理性质和某些化学性质方面却有很大差异。
|
|
CO2
SiO2 |
|||
|
与碱性氧化物反应 |
酸 性 氧 化 性 |
|||
|
CaO+CO2=CaCO3 |
 CaO+SiO2 CaSiO3 |
|||
|
与碱液反应 |
 2NaOH+CO2=Na2CO3+H2O 2NaOH+CO2=Na2CO3+H2O |
SiO2+2NaOH
= Na2SiO3+H2O |
||
|
与盐反应 |
C6H5Ona+CO2+H2O→
+NaHO3 Na2SiO3+CO2+H2O=Na2CO3 +H2SiO3↓ NaAlO2+CO2+2H2O=Al(OH)3↓ +NaHCO3 |
  2Na2CO3+SiO2 Na2SiO3+CO2↑ 2Na2CO3+SiO2 Na2SiO3+CO2↑CaCO3+SiO2 CaSiO3+CO2↑ (难挥发酸酐→易挥发酸酐) |
||
|
与碳反应 |
 C+CO2 2CO |
 2C+SiO2 Si+2CO |
||
|
与H2O作用 |
 CO2+H2O H2CO3 CO2+H2O H2CO3 |
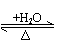
SiO2 H2SiO3 -H2O |
||
|
与酸反应 |
不反应 |
只与HF反应 SiO2+4HF=SiF4↑+H2O |
||
|
晶体类型 |
分子晶体 |
原子晶体 |
||
|
熔点 |
低(易升华) |
高 |
4.Si的非寻常性
(1)硅不活泼、但自然界无游离态,通常以硅酸盐形式存在
(2)硅不与一般的强酸、强氧化性酸反应,但常温却下HF反应,且能置换出其中的H。
Si+4HF==SiF4+2H2↑
(3)碳不与碱液反应,但硅常温即可与碱液反应并放出H2,表现出与Al有相似性。
Si+2NaOH+2H2O==Na2SiO3+2H2↑
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
其它固体非金属即使与碱液反应,一般也无H2产生。如
3S+6NaOH==2Na2S+Na2SO3+3H2O
5.碳酸正盐和酸式盐
(1)溶解性:
①大多正盐难溶于水(除K+、Na+、NH4+)
而一般酸式碳酸盐均可溶于水
②同一种阳离子的盐
一般:酸式盐>正盐
如 Ca(HCO3)2>CaCO3
KHCO3>K2CO3
但 NaHCO3<Na2CO3
想一想:为什么在饱和Na2CO3溶液中通入足量的CO2有晶体析出?
提示:Na2CO3+CO2+H2O==2NaHCO3
106g 18g 168g
①溶剂水量减少
②生成NaHCO3质量比消耗的Na2CO3质量大
③同温下溶解性 NaHCO3<Na2CO3
(2)与酸反应的过程及速度(同条件)
H++CO32-==HCO3-
HCO3-+H+==H2O+CO2↑
放出气体速度:HCO3->CO32-
(3)与碱液反应
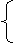 Na2CO3+NaOH→不反应
Na2CO3+NaOH→不反应
NaHCO3+NaOH==Na2CO3+H2O
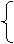 Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
2NaHCO3+Ca(OH)2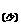 ==CaCO3↓+Na2CO3+H2O
==CaCO3↓+Na2CO3+H2O
(4)热稳定性:
正盐>相应酸式盐

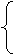 如: CaCO3 CaO+CO2↑
如: CaCO3 CaO+CO2↑
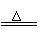
Ca(HCO3)2 CaCO3↓+H2O+CO2↑
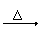
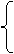 Na2CO3 不分解
Na2CO3 不分解
2NaHCO3 Na2CO3+CO2↑+H2O
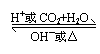 (5)相互转化:
(5)相互转化:
正盐(CO32-) 酸式盐(HCO3-)
(一)构建知识网络
一方面抓住典型物质作为核心,尽可能向外发散和向内收效,甚至可扩展到相关的有机知识,另方面要区分条件的不同(如温度、用量、酸碱性等),尽量分类整理,做到有序存档。
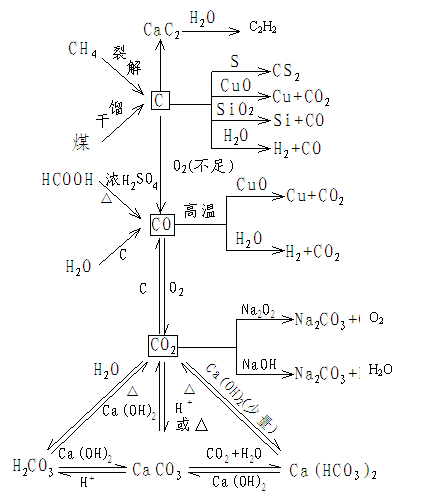
1.碳元素及其化合物的转化
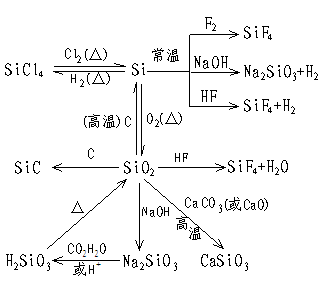
2.硅元素及其化合物的转化
35.(10分)向8 g某一价或二价金属的氧化物固体中加入适量10%的稀H2SO4(密度为1.07 g/cm3),使其完全溶解,已知所耗的硫酸体积为92 mL。在所得溶液中插入铂电极进行电解,通电一定时间后,在一个电极上收集到224 mL(标准状况)氧气,在另一个电极上析出该金属1.28 g。
(1) 根据计算确定金属氧化物的名称;
(2) 计算通电完毕后硫酸溶液的物质的量浓度。(溶液体积以消耗的硫酸体积92 mL为准)
34.(6分)往100 mL溴化亚铁溶液中缓慢通入2.24 L(标准状况)氯气,反应完成后溶液中有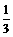 的溴离子被氧化成溴单质。求原溴化亚铁溶液的物质的量浓度。
的溴离子被氧化成溴单质。求原溴化亚铁溶液的物质的量浓度。
(提示:2Fe2++Br2 = 2Fe3++2Br-,不考虑氯气与水的反应)
33.(5分)把NH4HCO3、CuSO4、MgCl2、Al2(SO4)3固体混合物溶于水中,加入过量盐酸后,再加入过量氢氧化钠溶液,过滤,把滤液加热煮沸后,溶液中大量存在的离子是_____________________________。
32.(7分)工业上从海水中提出取溴常采用如下方法:
(1) 向海水中通入Cl2,将海水中的溴化物氧化,这一过程所发生的反应属于非金属间的___________反应;
(2) 向上述混合溶液中吹入热空气,将生成的溴吹出,用纯碱液吸收,生成NaBr、NaBrO3,这一过程可用离子方程式表示为:________________________________;
(3) 将(2)所得混合液用H2SO4酸化,使NaBr和NaBrO3中的溴转化为单质溴。这一过程可用化学方程式表示为____________________________________________;
(4) 这样得到的液溴中还混有少量Cl2,除去Cl2的方法是___________________。
31.(6分)黑色固体物质A有以下转化关系。每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温为无色气体,D、E有共同的阳离子。
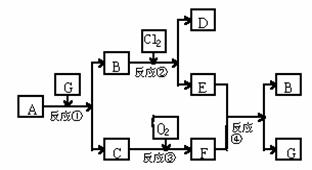
(1) 写出B和C的化学式:B__________;C__________。
(2) 写出反应④的离子方程式:_____________________________________________。
30.(6分)120℃、101.3 kPa条件下,有2 L H2O、2 L CO、1 L CO2、0.5 L O2和1 L H2组成的混合气体。将混合气体通过分别装有足量Cu粉、C粉和CuO粉的三个灼热的反应管。假设气体通过每个反应管都能充分反应,且不论三个反应管以何种顺序排列,问:
(1) 尾气是否有可能是单一气体?___________(填“可能”或“不可能”)。若可能,该气体是_________。
(2) 原气体是否有几种或一种不可能再存在于尾气之中?__________(填“有”或“没有”)。若有,它们(或它)是______________。
(3) 原气体中是否有一种或几种肯定存在于尾气之中?___________(填“有”或“没有”)。若有,它们(或它)是______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com