
题目列表(包括答案和解析)
21.自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作为宝石。已知该尖晶石中混有Fe2O3。取一定量样品5.4g,与一定浓度100ml盐酸反应恰好使其完全溶解,则盐酸的浓度可能是 ( )
A.0.8 mol/L B.2.8 mol/L C.4.0 mol/L D.4.9 mol/L
|
20.一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol
Z,下列说法正确的是 (
)
Z(g),经60 s达到平衡,生成0.3 mol
Z,下列说法正确的是 (
)
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若升高温度Y的转化率减小,则正反应为吸热反应
D.达到平衡时,X与Y 的浓度相等
19.已知Be和 Al在周期表中处于对角线位置 ,性质相似。反应BeCl2 + Na2BeO2 + 2H2O = 2NaCl + 2Be(OH)2↓能完全进行,则下列推断中正确的是 ( )
A.BeCl2溶液的pH<7,将其蒸干并灼烧后,得到的残留物为Be(OH)2
B.Na2BeO2溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C.Be(OH)2既能溶于盐酸又能溶于烧碱溶液
D.因为BeCl2水溶液的导电性强,所以BeCl2一定是离子化合物
18.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-)
17.用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按图所示步骤分离五种离子,则溶液①、②、③、④分别是 ( )
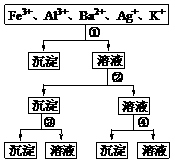
A.①NaCl ②NaOH ③NH3·H2O ④ H2SO4
B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①NaCl ②NH3·H2O ③NaOH ④H2SO4
16.室温时,下列混合溶液的pH一定小于7的是 ( )
A.pH = 3的盐酸和pH = 11的氨水等体积混合
B.0.1mol/L的盐酸和0.1mol/L的碳酸钠溶液等体积混合
C.0.05mol/L的硫酸和0.1mol/L的氨水溶液等体积混合
D.pH = 3的硫酸和pH =3的氢氧化钡溶液等体积混合
15.根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是 ( )
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
CH4 |
C2H4 |
C3H8 |
C4H8 |
|
C6H12 |
C7H16 |
C8H16 |
A.6 B.5 C.4 D.3
14.右图是温度和压强对X+Y 2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
( )
2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
( )
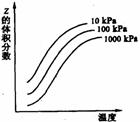 A.X和Y中只有一种为气态,Z为气态
A.X和Y中只有一种为气态,Z为气态
B.X、Y、Z均为气态
C.上述反应的正反应为吸热反应
D.改变压强不能使上述平衡发生移动
13.在重水中存在下述电离平衡: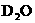

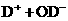 ,因此,对重水(
,因此,对重水(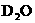 )可采用pH一样的定义来规定pD,那么pD=-lg[D+].已知在某温度下D2O达电离平衡时,[D+]×[OD-]=1.6×10-15,则在下列叙述中:①用0.01 mol NaOD和D2O配成1 L溶液,其pD=2;②把0.01 mol
DCl溶于D2O中,配成1 L溶液,其pD=2;③纯净D2O在此温度下的pD大于7;④用D2O配制0.2mol/L FeCl3溶液,溶液中Cl-浓度恰好是Fe3+浓度的3倍.其中说法正确的组合是
( )
)可采用pH一样的定义来规定pD,那么pD=-lg[D+].已知在某温度下D2O达电离平衡时,[D+]×[OD-]=1.6×10-15,则在下列叙述中:①用0.01 mol NaOD和D2O配成1 L溶液,其pD=2;②把0.01 mol
DCl溶于D2O中,配成1 L溶液,其pD=2;③纯净D2O在此温度下的pD大于7;④用D2O配制0.2mol/L FeCl3溶液,溶液中Cl-浓度恰好是Fe3+浓度的3倍.其中说法正确的组合是
( )
A.①② B.①④ C.③④ D.②③
12.用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是 ( )
A.酸式滴定管未润洗就装标准液滴定
B.锥形瓶未用待测液润洗
C.读取标准液读数时,滴前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com