
题目列表(包括答案和解析)
26.(8分)解 :
5C2O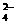 - 2MnO
- 2MnO
5 2
x mol 0.02×20×10-3 mol
x= 1×10-3 mol (2分)
∴用于与MnO2反应的C2O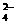 为:
为:
( - 1×10-3mol×
- 1×10-3mol×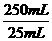 ) =0.01mol
(2分)
) =0.01mol
(2分)
∵MnO2 - C2O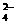
1 1
y mol 0.01 mol
y = 0.01 mol (2分)
∴MnO2%=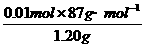 ×100%=72.5%
(2分)
×100%=72.5%
(2分)
26.(8分)已知KMnO4、MnO2在酸性条件下将草酸钠(Na2C2O4)氧化,离子反应为:
2MnO4-+5C2O42-+16H+==2Mn2++10CO2↑+8H2O
MnO2+C2O42-+4H+==Mn2++2CO2↑+2H2O
为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g无水草酸钠固体,再加入足量的稀硫酸(杂质不反应),充分反应后将所得溶液转移到250mL容量瓶中, 用蒸馏水稀释至刻度,摇匀后从中取出25.00mL,再用0.02mol/L KMnO4溶液滴定。当滴入20.00mLKMnO4溶液时恰好完全反应。
求该软锰矿中MnO2的质量分数。
25.
 (10分) (1)(各2分 )
CH3COO-
(10分) (1)(各2分 )
CH3COO-
 (2))C6H5O- + CO2 + H2O
C6H5O- + HCO3-
(2分)
(2))C6H5O- + CO2 + H2O
C6H5O- + HCO3-
(2分)
C2H518OH +CH3COOH=====CH3CO18OC2H5 + H2O (2分)
(3)4(2分)
25.(10分)有机物A(C8H8O2)为一种无色液体。从A出发可发生如下一系列反应
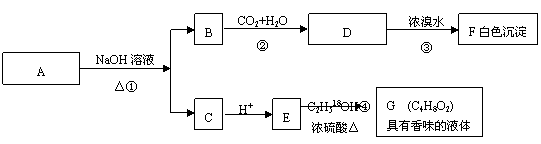
请回答:
(1)A和F的结构简式:A , F 。
(2)反应②的离子反应方程式: 。
反应④的化学反应方程式: 。(请注明示踪18O原子)
(3)A的同分异构体甚多,其中属于羧酸类的化合物,且含有苯环结构的异构体有____种。
24.(共8分,每空2分)
(1)羟基 羧基
(2)①③ (写对1个给1分,多写或写错没有分)


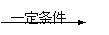 Br
OH
Br
OH
(3)HOOC-CH-CH2-COOH+H2O HOOC-CH-CH2-COOH+HBr(不写条件不扣分)
24.(8分)苹果酸是一种常见的有机酸,其结构为:
 OH
OH
HOOC-CH-CH2-COOH
(1)苹果酸分子所含官能团的名称是 、 。
(2)苹果酸不可能发生的反应有 (选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
⑤消去反应 ⑥取代反应
(3)物质A(C4H5O4Br)在一定条件下可发生水解反应,得到苹果酸和溴化氢。由A制取苹果酸的化学方程式是 。
23、(10分) (1) C (2分);
(2) Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+ (各2分) B、C (2分)
(3) Ti14C13 (2分)
23、(10分)2000年在河南发现世界级特大金红石 (含TiO2) 矿床。钛和钛合金及其重要化合物,在许多领域具有广泛、重要的应用,被称为21世纪的金属。
(1) 钛元素的同位素有: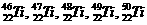 ,则下列说法正确的是 ( )
,则下列说法正确的是 ( )
A、据此可计算出钛元素的相对原子质量为48
B、钛元素的五种同位素化学性质均不相同
C、钛元素在元素周期表中位于第四周期
D、钛与铁 (26Fe) 同为第VIII族元素
(2)TiO2(二氧化钛) 是高级的白色颜料,它可用下列反应制得:
第一步:FeTiO3+2H2SO4 ===== TiOSO4+FeSO4+2H2O
此时,钛铁矿中的Fe2O3也与H2SO4发生反应,可加入铁屑使其还原成Fe2+,写出此过程的离子反应方程式: 。
第二步:TiOSO4+2H2O
 TiO2·H2O
+H2SO4; △H
> 0
TiO2·H2O
+H2SO4; △H
> 0
制二氧化钛的关键是第二步水解反应。为使第二步反应进行得更完全,可采用下列 措施。
A、加酸 B、加碱 C、加热 D、加压
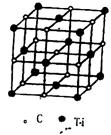 (3) 最近发现一种由钛原子和碳原子构成的气态团簇分子,如图所示,则它的化学式为
(3) 最近发现一种由钛原子和碳原子构成的气态团簇分子,如图所示,则它的化学式为
22.(共12分,每空2分)
(1)N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol
(2)O2+2H2O+4e-=4OH-
N2H4+4OH--4e-=4H2O+N2↑
(3)①Cu2++2e-=Cu ②112
(4)ClO-+2NH3=N2H4+Cl-+H2O
22.(12分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼-空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
(3)下图是一个电化学过程示意图。
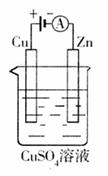
①锌片上发生的电极反应是 。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼
一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com