
题目列表(包括答案和解析)
1.维生素C(C4H8O6)主要存在于蔬菜和水果之中,它能促进人体生长发育,增强人体对疾病的抵抗力。下列关于维生素C的说法正确的是
A.维生素C是氧化物
B.维生素C由4个碳元素﹑8个氢元素﹑6个氧元素组成
C.维生素C中C﹑H﹑O三种元素的质量比为9:1:12
D.青少年应该多吃水果,切忌偏食
24.(10分)(1)中学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,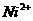 与最邻近
与最邻近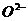 的核间距离为
的核间距离为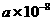 cm,计算NiO晶体的密度。(已知NiO的摩尔质量为
cm,计算NiO晶体的密度。(已知NiO的摩尔质量为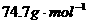 )
)
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图6-9所示的缺陷:一个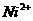 空缺,另有两个
空缺,另有两个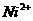 被两个
被两个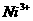 所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为
所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为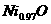 ,试计算该晶体中
,试计算该晶体中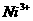 与
与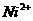 的离子数之比。
的离子数之比。
23.(8分)某离子晶体晶胞结构如图6-8所示,X位于立方体的顶点,Y位于立方体中心。试分析:
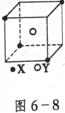
(1)晶体中每个Y同时吸引着_____________个X,每个X同时吸引着____________个Y,该晶体化学式为_____________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有____________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为_____________________(填角的度数)。
(4)设该晶体的摩尔质量为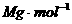 ,晶体密度为
,晶体密度为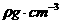 ,阿伏加德罗常数为
,阿伏加德罗常数为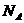 ,则晶体中两个距离最近的X中心间的距离为_________cm。
,则晶体中两个距离最近的X中心间的距离为_________cm。
22.(14分)单质硼有无定形和晶体两种,参考下表数据。
|
|
金刚石 |
晶体硅 |
晶体硼 |
|
熔点/K |
>3823 |
1683 |
2573 |
|
沸点/K |
5100 |
2628 |
2823 |
|
硬度/Moh |
10 |
7.0 |
9.5 |
(1)晶体硼的晶体类型属于_________,理由是__________;
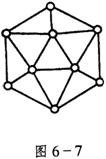
(2)已知晶体的结构单元是由硼原子组成的正二十面体(如图6-7所示),其中有20个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由_____________个硼原子构成,其中B-B键的键角为____________,共含有____________个B-B键;
(3)若将晶体硼结构单元中的每一个顶角均削去,余下部分结构就与 的结构相同,则
的结构相同,则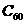 由_____________个正六边形和___________个正五边形构成。
由_____________个正六边形和___________个正五边形构成。
21.(8分)BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,这是锗酸铋的简称。若知:①在BGO中,锗处于其最高价态;②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构;③BGO可看成是锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。
请填空:
(1)锗和铋元素符号分别是_________和_________。
(2)BGO晶体的化学式__________。
(3)BGO晶体中所含铋氧化物的化学式是___________。
20.(14分)A、B、C、D、E、F为原子序数依次增大的同周期的主族元素,已知A、C、F三原子的最外层共有10个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3,回答:
(1)写出下列元素的符号:B________、D________、E__________。
(2)写出B、F形成化合物的电子式___________。
(3)A、C两种元素最高价氧化物的水化物反应的离子方程式_______________________。
(4)D的固态氧化物是__________晶体、含nmol的氧化物的晶体中含D-O共价健为___________mol。
19.(10分)(1)在石墨的平面网状结构上,含有共价键形成的碳原子环,每个环上有________个碳原子,任意两个C-C键的夹角都是________。在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有________个碳原子,任意两个C-C键的夹角都是__________。
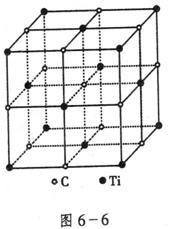
(2)最近发现一种由钛原子和碳原子构成的气态团簇分子,如图6-6所示,则它的化学式为:______________。
18.(6分)将下列变化过程中破坏的作用力名称填在横线上:
(1)NaOH熔化_____________;
(2)干冰升华_________;
(3) 熔化________;
熔化________;
(4)HCl溶于水________;
(5)NaCl溶于水__________;
(6)Na熔化____________。
17.(10分)已知有关物质的熔沸点数据如下:
|
物质 |
MgO |
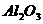 |
 |
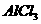 |
|
熔点/℃ |
2852 |
2072 |
714 |
190(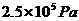 ) ) |
|
沸点/℃ |
3600 |
2980 |
1412 |
182.7 |
请参考上述数据填空和回答问题:
(1)工业上常用电解熔融 的方法生产金属镁,电解
的方法生产金属镁,电解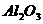 与冰晶石熔融混合物的方法生产金属铝,而不用电解熔融MgO的方法生产镁的原因是__________________,也不用电解熔融
与冰晶石熔融混合物的方法生产金属铝,而不用电解熔融MgO的方法生产镁的原因是__________________,也不用电解熔融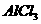 的方法生产铝的原因是____________;
的方法生产铝的原因是____________;
(2)设计实验,证明 、
、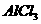 所属晶体类型,其实验方法是_______________。
所属晶体类型,其实验方法是_______________。
16.(10分)根据实验室中测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写)_____________。
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚 H.干燥器 I.石棉网 J.三脚架
除上述仪器外,还需要的仪器是___________。
(2)某学生实验后得到以下数据
|
加热前质量 |
加热后质量 |
|
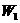 (容器) (容器) |
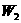 (容器+晶体) (容器+晶体) |
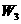 (容器+无水硫酸铜) (容器+无水硫酸铜) |
|
5.4g |
7.9g |
6.8g |
请写出结晶水含量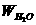 的计算公式(用
的计算公式(用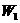 ,
,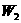 ,
,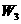 表示)_____________;该学生测定结果是偏高还是偏低?_______________,从下列分析中进行选择,该学生实验误差的原因可能是(填写字母)_____________。
表示)_____________;该学生测定结果是偏高还是偏低?_______________,从下列分析中进行选择,该学生实验误差的原因可能是(填写字母)_____________。
A.加热前称量时容器未完全干燥
B.最后两次加热后的质量相差较大(大于0.1g)
C.加热后容器未放入干燥器中冷却
D.加热过程中有少量晶体溅失
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com