
题目列表(包括答案和解析)
1. 钢铁发生吸氧腐蚀时,正极上发生的电极反应是 A.2H++2e-= H2 B.Fe2++2e- = Fe C.2H2O+O2+4e-= 4OH- D.Fe3++e- = Fe2+ 2. 下列关于铜电极的叙述, 不正确的是
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时铜作阳极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
(三)两种电解质溶液混合后离子浓度大小的比较:
1. 强酸与弱碱混合(或强碱与弱酸混合):
a. 恰好反应时,主抓两溶液混合生成强酸弱碱盐的水解情况;
b. 当弱碱(或弱酸)剩余时,溶液的酸碱性由强酸弱碱盐(或强碱弱酸盐)水解和弱碱(或弱酸)的电离相对大小决定。
2. 强碱弱酸盐与强酸混合(或强酸弱碱盐与强碱混合);主抓两溶液混合后生成的弱酸(或弱碱)的电离。
当弱酸(或弱碱)与盐的浓度相同时,通常情况,弱酸(弱碱)的电离程度大于强碱弱酸盐(强酸弱碱盐)的水解程度。
3. 强碱弱酸盐与弱酸混合(或强酸弱碱盐与弱碱混合)主抓题设中的条件。
[模拟试题]
有关pH计算:
1. 常温下,从pH=3的弱酸溶液中取出1mL的溶液,加水稀释到100mL,溶液的pH为_________。
2. 常温下,等体积混合0.1mol/L盐酸和0.06mol/L氢氧化钡溶液后,溶液的pH为_________。
3. 在25℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸pH与强碱的pH之间的关系应满足____________。
4. 某温度时,水的KW=10-13,将该温度下pH=11的NaOH溶液aL与pH=1的硫酸溶液bL混合。
(1)若所得混合液为中性,则a:b=________
(2)若所得混合液的pH=2,则a:b=________
(3)若所得混合液的pH=10,则a:b=________
5. 常温下,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合后pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的关系是______________。
6. 分析下列室温下等体积的酸和碱溶液,混合后pH的情况:
(1)pH=3的硝酸跟pH=11的氢氧化钾溶液:
(2)pH=3的盐酸跟pH=11的氨水:
(3)pH=3的硫酸跟pH=11的氢氧化钠溶液:
(4)pH=3的醋酸跟pH=11的氢氧化钡溶液:
7. 常温下,把80mLNaOH溶液加入到120mL盐酸中,所得溶液的pH=2,如果混合前NaOH溶液和盐酸的物质的量浓度相同,则它们的浓度是___________。
8. 常温下,一元碱A与0.01mol/L的一元强酸等体积混合后所得溶液的pH为7。以下说法正确的是( )
A. 若A为强碱,其溶液的物质的量浓度等于0.01mol/L
B. 若A为弱碱,其溶液的物质的量浓度大于0.01mol/L
C. 反应前,A溶液中[OH-]一定是0.01mol/L
D. 反应后,混合溶液中阴离子的浓度大于阳离子浓度
9. 室温时,0.06mol/L硫酸溶液与0.01mol/L氢氧化钠溶液等体积混合后,所得溶液的pH为____________。
10. 在室温下将pH=3的强酸溶液和pH=12的强碱溶液混合,当混合溶液的pH=11时,强酸与强碱溶液的体积比是________。
11. 25℃,往V mLpH=a的H2SO4溶液中滴入pH=b的NaOH溶液10VmL时,溶液中 与Na+的物质的量之比恰好为1:2,则a与b之和为( )
与Na+的物质的量之比恰好为1:2,则a与b之和为( )
A. 13 B. 14 C. 15 D. 不能确定
12. 现有25℃pH=13的Ba(OH)2溶液:
(1)该Ba(OH)2溶液的物质的量浓度为_________;
(2)加水稀释100倍,所得溶液中由水电离出[OH-]=_____________;
(3)与pH=13的NaOH溶液按体积比1:4混合,所得溶液的pH=_________;
(4)与pH=10的NaOH溶液等体积混合,所得溶液中[H+]=___________;
(5)与某盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11,该盐酸溶液的pH=_________;
(6)加入一定体积浓度为Cmol·L-1的Na2SO4溶液恰好完全反应,所得溶液pH=12,则C值为___________。
电解质溶液中离子浓度的关系:
1. 在硫化钠溶液中,下列关系正确的是:( )
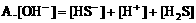
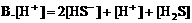
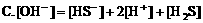
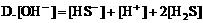
2. 在氯化铵溶液中,下列关系正确的是( )
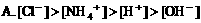
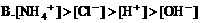
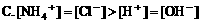
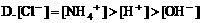
3. 在0.1mol/L氢硫酸溶液中,下列关系错误的是( )

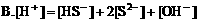
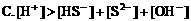
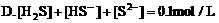
4. 在0.1mol/LNaHCO3溶液中,下列关系正确的是( )

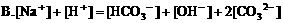
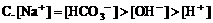
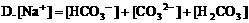
5. pH=3的盐酸与pH=11的氨水等体积混合,溶液中离子浓度关系正确的是( )
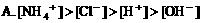
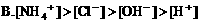
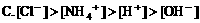
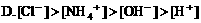
6. 浓度均为0.1mol/L的甲酸和NaOH溶液等体积混合后,下列关系正确的是( )
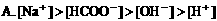
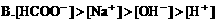
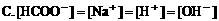
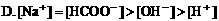
7. 0.2mol/L醋酸钾溶液与0.1mol/L盐酸等体积混合,溶液中下列微粒的物质的量浓度关系正确的是( )
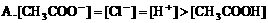
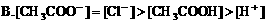
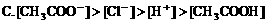

8. 0.1mol/LNaOH溶液与0.1mol/L氯化铵溶液等体积混合,溶液中离子浓度大小关系正确的是( )
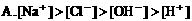
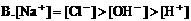
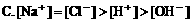
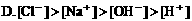
9. 在物质的量浓度均为0.01mol/L的醋酸和醋酸钠混合溶液中,测得[CH3COO-]>[Na+],则下列关系正确的是( )
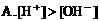
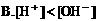
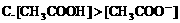
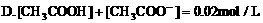

(二)一种电解质溶液中离子浓度大小的比较:
1. 强酸弱碱盐溶液:主抓弱碱离子水解平衡;
2. 强碱弱酸盐溶液:主抓弱酸根离子水解平衡;
3. 弱酸溶液:主抓弱酸的电离平衡;
4. 弱碱溶液:主抓弱碱的电离平衡;
5. 强碱弱酸溶液的酸式盐溶液:主抓酸式酸根离子的电离和水解两种平衡。
(一)运用好两个守恒关系:
1. 电荷守恒关系:阴阳离子电荷数相等,即溶液为电中性;
2. 物料守恒关系:即各种元素的原子个数在溶解前后保持不变。
此两种守恒关系,决定了溶液中离子间等式关系成立的基础。
(二)酸碱稀溶液pH值计算途径
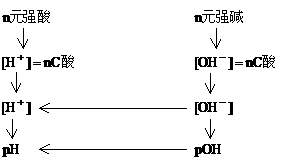
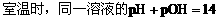
电解质溶液中离子浓度的关系:
(一)三种类型pH计算:
1. 电解质溶液加水稀释
(1)强电解质溶液的稀释;
(2)弱电解质溶液的稀释。
2. 不同浓度的强酸(或强碱)自相混合pH计算:
(1)酸I+酸II
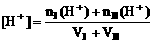
(2)碱I+碱II
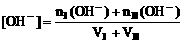
3. 酸碱混合溶液pH的计算:
(1)混合溶液呈中性:
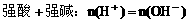

(2)混合溶液呈酸性:
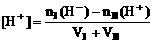
(3)混合溶液呈碱性:
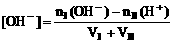
专题复习--有关pH计算、电解质溶液中离子浓度的关系
有关pH计算:
25.(6分)20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如右图所示。
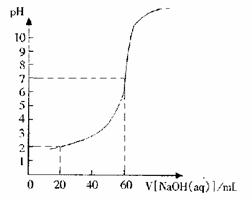 (1)试求X、Y的物质的量浓度之比。
(1)试求X、Y的物质的量浓度之比。
24.(6分)为了预防碘缺乏病,国家规定每千克食盐中应含有40-50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的Na2S2O3溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:IO3-+5I-+6H+=3I2+3H2O;I2+2S2O32-=2I-+S4O62-
22.(6分)2000年10月10日,诺贝尔化学奖授予美国科学家艾伦·黑格、艾伦·马克迪尔米德和日本科学家白川英树,以表彰他们有关导电聚合物的发现。他们研究发现:经过改造后的塑料能够像金属一样表现导电性能。以聚乙炔为例,要使其能够导电,必须用I2或Na等做掺杂处理,他们用碘做的掺杂实验通式如下:
[CH]n+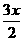 I2→[CH]
I2→[CH]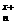 +xI
+xI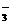
回答下列问题:
(1)聚乙炔的碳链结构片段可表示为 ( )
A.-C≡C-C≡C-C≡C- B.-C=C-C=C-C=C-
C.=C=C=C=C=C=C= D.-C=C-C≡C-C=C-C≡C-
(2)下列叙述正确的是 ( )
A.这种可导电的塑料是一种纯净物,有固定的熔、沸点
B.掺杂后的聚乙炔所以可导电,是因为它具有类似盐的结构
C.聚乙炔和碘的掺杂反应中,聚乙炔被还原
D.聚乙炔经掺杂反应后,分子内碳链结构未发生变化
(3)试写出用钠做掺杂实验的通式
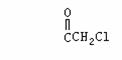 23.(6分)中国是《日内瓦协定书》的缔约国,2003年12月3日,发表了《中国的防扩散政策和措施》白皮书,重申反对使用化学武器,反对任何形式的化学武器扩散。苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式如下图所示:
23.(6分)中国是《日内瓦协定书》的缔约国,2003年12月3日,发表了《中国的防扩散政策和措施》白皮书,重申反对使用化学武器,反对任何形式的化学武器扩散。苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式如下图所示:
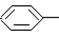
(1)苯氯乙酮不可能具有的化学性质是: (填序号)。
A.加成反应 B.取代反应 C.消去反应 D.水解反应 E.银镜反应
(2)与苯氯乙酮互为同分异构体,且能发生银镜反应,分子有苯环但不含-CH3的化合
物有多种,请举出两例,写出它们的结构简式:(这两例分子内必须含有不同的基
因)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com