
题目列表(包括答案和解析)
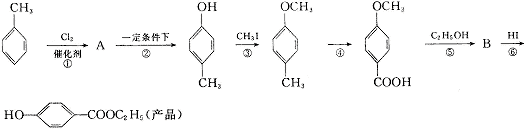
25.(10分)工业上可用甲苯生产对羟基苯甲酸乙酯 
(一种常用的化妆品防霉剂),其生产过程如下图(反应条件未全部注明)所示:
(1)有机物A的结构简式为 。
(2)反应物的化学方程式(要注明反应条件)为: 。
(3)反应②的类型属 反应,反应④属于 反应。
(4)反应③的方程式(反应条件不要写,要配平)为: 。
(5)在合成路线中,设计第③步反应的目的是: 。
24.(6分)在某些酶的催化下,人体内葡萄糖的代谢有如下过程:
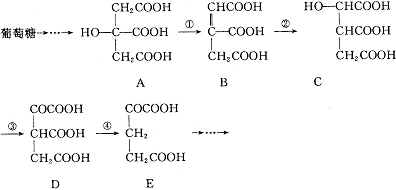
(1)过程①是 反应,过程②是 反应,过程③是 反应(填写反应类型名称)。
(2)过程④的另一种生成物是 (写化学式)
(3)上述物质中 和 互为同分异构体。
22.(10分)KClO3和浓盐酸在一定温度下反应会生成黄绿色易爆物二氧化氯,其表达式为: KClO3+ HCl(浓) KCl+ ClO2↑+
Cl2↑+ .
KCl+ ClO2↑+
Cl2↑+ .
(1)请完成上述方程式(未知化学式及计量数填入框内)。
(2)浓盐酸在反应中显示出来的性质是:(填写编号) 。
①只有还原性 ②具有还原性与酸性 ③只有氧化性 ④具有氧化性和酸性
(3)产生0.1 mol Cl2,则转移电子物质的量为 mol。
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的 倍。
|
①O2==== 2O ②O2+O====O3 则
(1)写出以上①②反应的总方程式 。
(2)氧气与臭氧互称为 。
|
①CF2Cl2====Cl+CF2Cl;② ;③O+ClO====Cl+O2
写出以上②、③反应的净结果 。
上述反应过程中,Cl是 (填序号)。
A.反应物 B.生成物 C.中间产物 D.催化剂
21.(6分)为方便某些计算,常可将98%的浓硫酸表示为硫酸水合物形式(H2SO4·19H2O)或SO3水合物形式(SO3·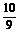 H2O),则98%的浓磷酸表示为磷酸水合物形式为
,表示为五氧化二磷水合物形式为
。
H2O),则98%的浓磷酸表示为磷酸水合物形式为
,表示为五氧化二磷水合物形式为
。
|
(1)试管乙中观察到的现象是 。
(2)加入浓硫酸的目的是 。
(3)该实验用到的球形管除冷凝作用外,另一重要作用是 。
(4)试管乙中饱和Na2CO3溶液的作用是 。
20.(12分)某课外活动小组模拟呼吸面具中原理(过氧化纳与潮湿的CO2反应),设计了用下列仪器来制取氧气并测量氧气的体积。
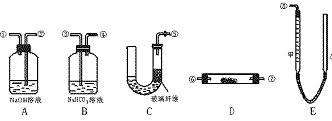
图4-2
图中量气装置E是由甲、乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50 mL);乙管可上下移动以调节液面高度。
实验室可供选择的药品还有:稀硫酸、盐酸、过氧化钠、大理石、水。试回答:
(1)上述装置的连接顺序是(填各接口编号,其中连接胶管及夹持用具均省略) 。
(2)装置C中放入的反应物是 。
(3)装置A的作用是 。装置B的作用是 。
(4)为了较准确地测量氧气体积,除必须检查各个装置气密性外,在读取反应前后甲管中液面高度,求其差值的过程中,应注意 和 。(填字母编号)
a.视线与凹液面最低处持平
b.等待片刻,待乙管中液面不再上升时立即读数
c.读数时应上下移动乙管,使甲、乙两管液面持平
d.读数时不一定使甲、乙两管液面持平
18.将20 mL 1 mol·L-1的NaOH溶液和10 mL 1 mol·L-1醋酸溶液混合后蒸干并强热,最后得到的固体是
A.NaOH B.CH3COONa
D.NaOH与CH3COONa混合物 D.Na2CO3
第Ⅱ卷(非选择题 共76分)
17.浅绿色的Fe(NO3)2溶液中存在着如下平衡:Fe2++2H2O Fe(OH)2+2H+,若在此溶液中加入盐酸,则溶液的颜色
Fe(OH)2+2H+,若在此溶液中加入盐酸,则溶液的颜色
A.变黄 B.变得更浅 C.颜色变深 D.不变
16.向含a mol AlCl3的溶液中滴入含b mol NaOH的溶液,充分反应后沉淀的物质的量不可能为
A.3b mol B.13b mol C.(4a-b) mol D.a mol
15.下列离子方程式正确的是
A.钠和冷水反应 Na+2H2O====Na++2OH-+H2↑
B.氯气与水反应 Cl2+H2O====2H++Cl-+ClO-
C.硫酸铝溶液和小苏打溶液反应 Al3++3HCO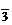 ====Al(OH)3↓+3CO2↑
====Al(OH)3↓+3CO2↑
D.向Ca(ClO)2溶液中通入SO2 Ca2++2ClO-+SO2+H2O====CaSO3↓+2HClO
14.下列各组离子在溶液中可以大量共存,且加入氨水后也不产生沉淀的是
A.Na+ Ba2+ Cl- NO B.H+ NH
B.H+ NH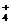 Al3+ SO
Al3+ SO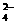
C.K+ AlO NO
NO OH- D.H+ Cl-
CH3COO-
NO
OH- D.H+ Cl-
CH3COO-
NO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com