
题目列表(包括答案和解析)
5.现将等物质的量的CuSO4、FeCl3、Zn放入盛有水的烧杯中充分反应,所得溶液中除SO42-、Cl-外,还含有的金属阳离子是: ( )
A.Zn2+、Cu2+、Fe3+ B.Zn2+ 、Fe2+、Cu2+、Fe3+
C.Zn2+、Cu2+、Fe2+ D.Zn2+、Fe3+
4.氢氧电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。以下有数种说法,正确的组合是( )
(1)负极反应为O2+2H2O+4e-→4OH-
(2)负极反应为2H2+4OH--4e-→4H2O
(3)电池工作时正极区pH升高,负极区pH下降
(4)电池工作时溶液中的阴离子移向正极
A.(2)(3) B.(2)(4) C.(1)(3)(4) D.(1)(4)
3.有两短周期元素x和y,可组成化合物xy3,当y的原子序数为m时,x的原子序数为
(1)m-4 (2)m+4 (3)m+8 (4)m-2 (5)m+6其中正确的组合是( )
A.(1)(2)(4) B.(1)(2)(5)
C.(1)(2)(3)(5) D.(1)(2)(3)(4)(5)
2.实现下列变化时,需克服相同类型作用力的是( )
A 液溴和液汞的气化 B 无色透明的水晶熔化和氯化氢气体溶于水
C 碘升华和水的分解 D 食盐和蔗糖的熔化
1、若溶液中由水电离产生的c(H+)=1×10-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
A Al3+ Na+ NO3- Cl- B K+ Na+ Cl- NO3-
C K+ Na+ Cl- AlO2- D K+ NH4+ SO42- NO3-
12、(16分)某化学反应2A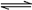 B+D在四种不同条件下进行,B,D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如表1:
B+D在四种不同条件下进行,B,D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如表1:
表1 A的浓度/(mol·L-1)随反应时间的变化
|
实验 序号 |
时间/min |
|
温度/℃ 0 10 20 30 40 50 60 |
|
|
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50 2 800 c2 0.60 0.50 0.50 0.50 0.50 0.50 3 800 c3 0.92 0.75 0.63 0.60 0.60 0.60 4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10min至20 min时间内平均速率为________mol/(L·min)。
(2)在实验2,A的初始浓度c2=______ mol/L,反应经20 min就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3________ V1(填>、=、<),且c3______1.0mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是______反应(选填吸热、放热)。理由是_________________________________________。
11、(11分)BiCl3水解生成BiOCl,溶液浑浊。
(1)写出其水解反应的化学方程式____________________________。
(2)医药上把BiOCl叫做次氯酸铋。你同意此名称吗?______________,其理由是_______________________________。
(3)如何配制BiCl3溶液?____________________________。
(4)把适量固体BiCl3置于浓NaCl溶液中可得澄清溶液,其原因是___________________
_________________________________________________________。
10、(12分)弱酸和它们的盐或弱碱和它们的盐组成的混合物的溶液称为缓冲溶液。缓冲溶液具有抵抗外来少量酸或碱的干扰,使溶液的PH基本保持不变(缓冲作用),人的血液中起缓冲作用的是由H2CO3和HCO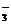 (弱酸盐)组成的缓冲对,其缓冲作用原理可表示为:HCO
(弱酸盐)组成的缓冲对,其缓冲作用原理可表示为:HCO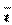 +H+= H2CO3 H2CO3+OH-= HCO
+H+= H2CO3 H2CO3+OH-= HCO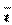 +H2O
+H2O
(1)含有一定量CH3COOH和CH3COONa的水溶液也具有缓冲作用,写出在此溶液中加入少量酸或碱时的离子方程式。
加入酸:____________________________
加入碱:____________________________
(2)请写出另外可形成缓冲溶液的两组物质:__________________________________,
______________________________________________________________________________。
9、(12分)一种新型电池是两根金属做电极插入氢氧化钾溶液中,然后向两极分别通入甲烷和氧气,其电极反应为:X极:CH4+10OH--8e=CO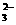 +7H2O
+7H2O
Y极:4H2O+2O2+8e=8OH- 请回答:
(1)指出该电池的正负极:正极______________,负极______________。
(2)放电一段时间后,电解质溶液中氢氧化钾的物质的量是否改变?为什么?答:______
____________________________________________________________________________,
____________________________________________________________________________。
(3)放电时,溶液的PH是否变化?答:_______________。
(4)在标准状况下,通入5.6L氧气,完全反应后有多少电子发生转移?答:______。
8、在容积固定的密闭容器充入一定量的X、Y两种气体,一定条件下,发生如下可逆反应,并达到平衡:3X(g)+Y(g)
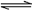 2Z(g)正反应是放热反应,测得X的转化率为37.5%,Y的转化率为X的2/3,下列有关叙述正确的是( )
2Z(g)正反应是放热反应,测得X的转化率为37.5%,Y的转化率为X的2/3,下列有关叙述正确的是( )
A、若测得X的反应速率为0.2mol/L·S,则Z的反应速率为0.3mol/L·S
B、 充入氦气,容器压强增大,Y的转化率提高
C、 开始充入容器中的X、Y物质的量之比为2∶1
D、升高温度,平衡向正反应方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com