
题目列表(包括答案和解析)
5、用一根洁净的铂丝蘸取第三支试管中的溶液,在酒清灯的外焰上灼烧。透过钴玻璃观察火焰的颜色。
4、向第二支试管中滴加BaCl2溶液和稀盐酸。观察溶液中民生的现象。解释现象民生的原因,写出有关反应的离子方程式。
3、向第一支试管中滴加NaOH溶液至过量。观察溶液中发生的现象。解释现象发生的原因,写出有关反应的离子方程式。
2、在三支试管中分别加入约0.5mL稀明矾溶液。
1、取少量明矾放入烧杯中。向烧杯中加入蒸馏水,搅拌,配制成稀溶液。
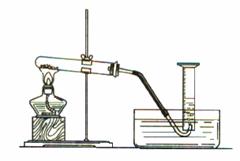
7、实验装置如图所示:
其中:大试管中的O2体积可抵消其原空气的体积;玻璃导管不应太长,应尽量短些;收集O2使用量筒等带有刻度的仪器;气体不必降至室温,否则会倒吸。如果在制取前即装配好制装置,会减小容器中空气占有量的误差。
第三册实验六答案:
6、分别用玻璃棒蘸取少量溶液滴在pH试纸上,呈强碱性的原溶是NaOH溶液。
取5支洁净试管,分别加入少量溶液,然后分别滴入几滴碘水,试管出现蓝色的,原溶液为淀粉溶液。
取四种剩余未检出的溶液,分别加入4支试管中,再各加入少量浓硝酸,试管中产生黄色的,原溶液为蛋白质。
再在3支试管中分别加入余下未检出的溶液,加入新制取的Cu(OH)2沉淀并加热,试管中有红色沉淀产生的原溶液为乙醛溶液。
 再在2支试管中分别加入最后两种未检出的溶液,分别加入少量FeCl3溶液,试管中有紫色出现的,原溶液为苯酚溶液,另一种为NaCl溶液。或是在最后两种未检出的溶液中加入AgNO3溶液,有白色沉淀产生的,原溶液为NaCl溶液,另一种则为苯酚溶液。
再在2支试管中分别加入最后两种未检出的溶液,分别加入少量FeCl3溶液,试管中有紫色出现的,原溶液为苯酚溶液,另一种为NaCl溶液。或是在最后两种未检出的溶液中加入AgNO3溶液,有白色沉淀产生的,原溶液为NaCl溶液,另一种则为苯酚溶液。
2、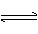 在盛有水的试管中加入少量Na2CO3固体,使它溶解。再滴入2滴酚酞试液,溶液呈红色(CO
在盛有水的试管中加入少量Na2CO3固体,使它溶解。再滴入2滴酚酞试液,溶液呈红色(CO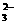 +H2O HCO3-+OH-)。加热这种溶液,红色加深,说明升温后
+H2O HCO3-+OH-)。加热这种溶液,红色加深,说明升温后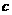 (OH-)增大,水解平衡向正反应方向移动,从而证明Na2CO3的水解是吸热反应。
(OH-)增大,水解平衡向正反应方向移动,从而证明Na2CO3的水解是吸热反应。
4、本实验就先除去硫酸根,然后再除去碳酸根。将混有少量硫酸钠和碳酸钠的氯化钠晶体溶解后,滴加氯化钡溶液。待硫酸根离子沉淀完全后,再向浑浊液中加入碳酸钠溶液(如果先过滤,再加碳酸钠,会增加一次过滤操作)。用pH试纸测试浑浊液,若pH在7以上,表示所加碳酸钠已足量,钡离子沉淀完全(教师应明确告诉学生,此时如果取少量滤液,加入氯化钡溶液或碳酸钠溶液来检查都不是好方法)。将浑浊液过滤,加入适量盐酸,使溶液呈弱酸性,最好再把溶液加热近沸,以驱除溶液中溶解的二氧化碳,得到纯净的氯化钠溶液。将溶液蒸发,即可得到纯净的氯化钠晶体。
第二册实验十三答案:
5、方法一:可通过液体的密度大小以及粘稠度等物理性质来区分。
方法二:可分别加入铝片。
方法三:可分别加入铜片,加热。
方法四:在点滴板的孔穴中放入少量硫酸铜晶体(或火柴梗或纸片),再分别滴入两种酸。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com