
题目列表(包括答案和解析)
2.我国城市中的大气污染物主要有
A.CO2、Cl2、N2、酸雨 B.HCl、SO2、N2、粉尘
C.SO2、NO2、CO、烟尘 D.NH3、CO2、CO、雾
1.航天技术测得三氧化二碳(C2O3)是金星大气层的成分之一,下列关于C2O3的说法中错误的是
A.C2O3与CO2都是碳的氧化物
B. C2O3与CO2都是碳酸的酸酐
C. C2O3与CO都具有还原性
D. C2O3与C充分燃烧的产物都是CO2
26.(8分)为了预防碘缺乏病,国家规定每千克食盐中应含有40 mg~50 mg KIO3。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428 g,设法溶解出其中全部的KIO3,将溶液酸化并加入足量的KI淀粉溶液,溶液呈蓝色,再用0.030 mol·L-1的硫代硫酸钠溶液滴定,用去18.00 mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:
IO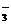 +5I-+6H+====3I2+3H2O
+5I-+6H+====3I2+3H2O
I2+2S2O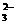 ====2I-+S4O
====2I-+S4O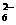
25.(8分)今有FeCl2、CuCl2混合溶液400 mL,经测定其中c(Cl-)为a mol·L-1,投入足量的锌粉b g,充分反应后过滤,所得固体残渣经洗涤干燥后,质量为c g,求原混合溶液中Fe2+、Cu2+的物质的量浓度。(只考虑金属与盐的完全反应)
24.(12分)1,4-丁二醇是生产工程塑料PBT(聚对苯二甲酸丁二酯)的重要原料,它可以通过下图两种不同的合成路线制成,请写出序号物质的结构简式。
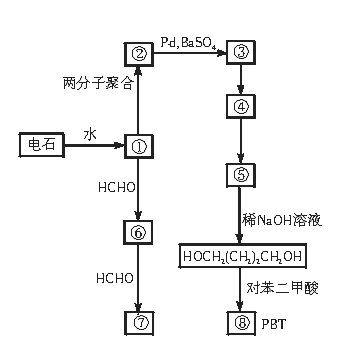
① ② ③ ④
⑤ ⑥ ⑦ ⑧
23.(11分)据报道,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS-Na(对氨基水杨酸钠)也是其中一种。它与雷米封同时服用,可以产生协同作用。
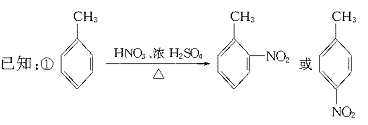
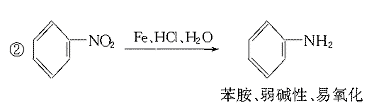
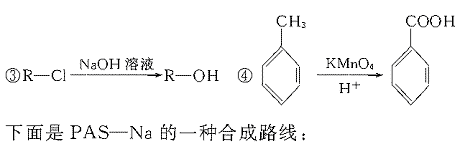
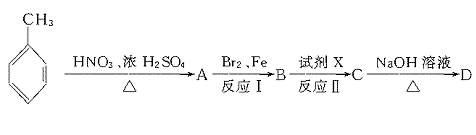
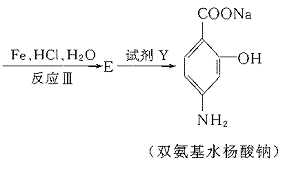
(1)写出下列反应的化学方程式:
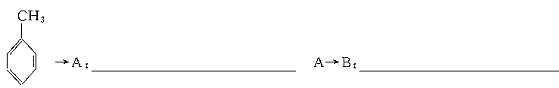
(2)写出下列物质的结构简式:C. ,D.
(3)指出反应类型:Ⅰ ,Ⅱ ,Ⅲ
22.(6分)1998年Murad等三位教授因研究NO分子在人体内的独特功能而获诺贝尔奖。
(1)NO对环境的危害在于 。
A.破坏臭氧层 B.形成酸雨
C.高温下能使一些金属被氧化 D.与人体的血红蛋白结合
(2)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性溶液中反应的离子方程式 。
(3)常温下把NO气体压缩到100个大气压,在一个体积固定的容器内加热到50℃,发现气体压强迅速下降,降至略小于原压强的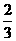 就不再改变 ,已知产物之一为N2O,写出上述变化的化学方程式
。
就不再改变 ,已知产物之一为N2O,写出上述变化的化学方程式
。
21.(8分)已知25℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因而pH增大。你认为上述解释中 (“甲”或“乙”)正确。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量的下列物质中的 (填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2)若 (填“甲”或“乙”)的解释正确,溶液的pH应 (填“增大”“减少”或“不变”)。
20.(14分)按如图装置和以下实验步骤,可以制取少量的溴苯和溴乙烷。①按图连接仪器装置,并检查装置的气密性;②气密性良好,再向烧瓶中加入少量苯和液溴,向锥形瓶中加入乙醇和浓硫酸混合液至恰好浸没导管C出口;③将A装置中的纯铁丝小心地向下插入液体中;④点燃B装置中的酒精灯,用小火缓缓地对锥形瓶加热10 min。据此填写和回答下列要求:
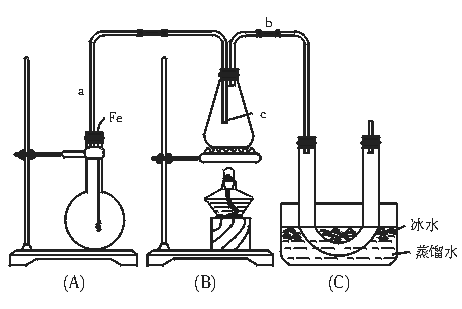
(1)写出本题制取溴苯和溴乙烷的两个化学方程式 、
。
(2)将铁丝小心地向下插入A烧瓶内液体中,观察到的现象是 。
(3)长导气管a的作用是 ,导管b的作用是 。
(4)U形管内用蒸馏水封住管底,其作用是 。
(5)反应完毕后,U型管内的现象是 ;分离出溴乙烷所用到的主要仪器的名称是 。
19.(9分)实验室制取乙酸乙酯,有如下实验步骤:①向干燥的大试管中加入3 mL无水乙醇,2 mL浓硫酸,2 mL冰醋酸;②把仪器安装好,用酒精灯小心加热试管3~5分钟;③馏出成分用饱和碳酸钠溶液吸收;④将馏出物质和饱和碳酸钠溶液倒入分液漏斗中,进行分液即得到乙酸乙酯。请填写以下空白:
(1)步骤①加入浓硫酸的注意事项是 。
(2)在接收馏出成分的装置中,饱和碳酸钠溶液所起的作用是 。
(3)用分液漏斗分液时,将混合液体倒入分液漏斗后, 后,分出下层液体 (填“酯液”或“水液”)至 ,关闭分液漏斗的活塞。剩下的上层液体
出。(填“从上口倒出”或“从下口倒出”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com