
题目列表(包括答案和解析)
21、(1)B;(2)CH3COONH4溶液显中性,这样可以证明哪个同学的解释正确;(3)乙;
20、(1)阳极:Fe-2e-=Fe2+;阴极:2H++2e-=H2↑
(2)Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(3)随着反应的进行,H+浓度不断降低,OH-浓度不断升高,最后就生成了Cr(OH)3、Fe(OH)3沉淀。
19、(1)H2O2
 HO2-+H+;HO2-
HO2-+H+;HO2- H++O22-
H++O22-
(2)H2O2+Ba(OH)2= Ba O2+2 H2O;
2H2O2+Ba(OH)2= Ba(HO2)2+2 H2O;
(3)2 H2O2 HO2-+H3O2+
HO2-+H3O2+
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
B |
D |
D |
A |
C |
D |
D |
C |
D |
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
C |
B |
A |
C |
D |
C |
CD |
B |
C |
24(12分)、某温度下将一定量密度为1.15克/毫升的氯化钠溶液用惰性电极电解,设氯化钠恰好完全电解且无其它反应发生时,得到的溶液中氧元素的质量分数为80%,试计算:
(1) 电解后溶液中溶质与溶剂的物质的量之比。
(2)原氯化钠溶液的物质的量浓度。
25(12分)、向8克二价金属的氧化物固体中加入稀硫酸,使其恰好完全溶解,已知所消耗的硫酸体积为100毫升,在所得溶液插入铂电极进行电解,通电一定时间后,在一个电极上收集到224毫升(标准状况)氧气,在另一个电极上得到1.28克该金属。 (1)根据计算确定金属氧化物的名称。 (2)计算通电后硫酸溶液的物质量浓度(溶液体积按100毫升计算)。
高三单元测验
(原电池、电解池、电解质溶液)答案
21(12分)、已知氨水的电离程度与醋酸的电离程度在同温度、同浓度下相等,溶有一定量氯化铵的溶液呈酸性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是:
①Mg(OH)2(固体)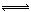 Mg2++2OH-;
Mg2++2OH-;
②NH4+
+H2O NH3•H2O+H+ ;③H+ +OH- =H2O;
NH3•H2O+H+ ;③H+ +OH- =H2O;
由于NH4+ 水解显酸性,H+ 与OH- 反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
①Mg(OH)2(固体)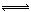 Mg2++2OH-;②NH4+ +OH-
Mg2++2OH-;②NH4+ +OH- 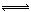 NH3•H2O;
NH3•H2O;
由于NH4Cl电离出的NH4+ 与Mg(OH)2 电离出的OH- 结合,生成了弱的电解质NH3•H2O,导致反应①的平衡右移,Mg(OH)2 沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是: (填编号)
A、NH4NO3;B、CH3COONH4;C、Na2CO3;D、NH3•H2O;
(2)请你说明丙同学做出该选择的理由: ;
;
(3)丙同学将所选试剂滴入Mg(OH)2 的悬浊液中,Mg(OH)2 溶解;有此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2 溶解的离子方程式为: ;
22(12分)、从H+、Na+、Cu2+、Ba2+、Cl-、SO42-离子中,选出恰当的离子组成一种电解质,将电解质溶液按下列要求进行电解(均是惰性电极):
(1) 电解时电解质含量减小,水量不变,则所采用的电解质是 ;
(2)电解时电解质的质量保持不变,水量减小,则所采用的电解质是 ;
(3)电解时电解质和水的质量都发生变化,则所采用的电解质是 ;
23(8分)、常温下将0.01molCH3COONa和0.004molHCl溶于水,配制0.5L混合溶液。判断:⑴溶液中共有 种微粒;⑵溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是 和 ;
⑶溶液中n(CH3COO-)+n(OH-)-n(H+)= mol。
19(10分)双氧水(H2O2)和水都是极弱的电解质,但H2O2 比H2O更显酸性。
(1)若把H2O2 看成是二元酸,请写出它在水中的电离方程式:
;
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也形成酸式盐。请写出 H2O2和Ba(OH)2作用形成盐的化学方程式:
;
(3)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,双氧水也有极弱的自偶电离,其自偶电离的方程式为: ;
20(12分)、工业上处理含Cr2O72-的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。试回答:
(1)电解时的电极反应: 阳极
阴极
(2)写出Cr2O72-转变成Cr3+的离子反应方程式:
(3)电解过程中Cr(OH)3、Fe(OH)3沉淀是怎样产生的?
18、中和相同体积、相同PH值的Ba(OH)2、NaOH和NH3·H2O三种稀溶液所用相同浓度的盐酸体积分别为V1、V2和V3,则三者关系为:
A、V1>V2>V3 B、V3 =V2>V1 C、V3 >V2=V1 D、V1=V2>V3
Ⅱ卷(共78分)
17、PH值等的盐酸和醋酸,分别稀释到原来的n倍m倍,稀释后两溶液的PH值仍相等,则n和m的关系是
A、m=n B、m>n C、m<n D、m³n
16、把100毫升、2摩/升的NaOH溶液,100毫升、2摩/升的H2SO4溶液以及一定量的氨水混合,所得的溶液使酚酞试液显浅红色,则溶液中离子浓度关系正确的是:
A、C(SO42-)=C(Na+)>C(NH4+)>C(OH-)>C(H+); B、C(Na+)>C(SO42-)>C(NH4+)>C(OH-)>C(H+);
C、C(NH4+)>C(SO42-)=C(Na+)>C(OH-)>C(H+) D.C(H+)+C(NH4+)+C(Na+) = C(OH-)+2C(SO42-);
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com