
题目列表(包括答案和解析)
6.水杨酸的同分异构体中属于酚类,但是不属于酯类,也不属于羧酸类的化合物必定含有
A.-O-CH3 B.-COO-
C.-CHO D.-COOH
5.将水杨酸跟哪种物质的溶液反应可得到一种钠盐,其化学式为C7H5O3Na
A.NaOH B.Na2CO3
C.NaHCO3 D.NaCl
1.下列各项属于“绿色化学”的是
A.处理废弃物 B.治理污染点
C.减少有毒物 D.杜绝污染物
[例题分析]
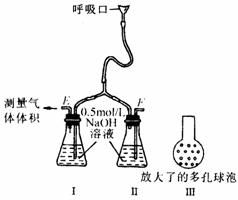
例1.四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃,拟利用图中的仪器,设计组装一套实验装置,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)。请回答下列各问题。
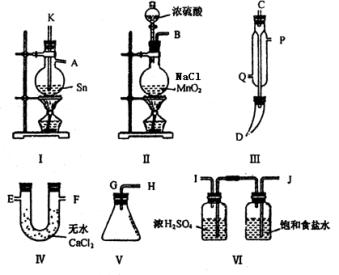 (1)用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)________接________、________接________、________接________、________接________、________接________。
(2)装置Ⅵ的作用是___________;装置Ⅳ的作用是_____________。
(3)冷凝管理冷却水的流向是从__________进入,从__________流出。
(4)实验时应先点燃_____________处酒精灯,加热温度应大于______________℃,待__________即可停止加热。
(5)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为________。
(6)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是____________。
(7)为了防止污染空气,在装置的最后应____________。
分析:这是一个制备实验。
实验目的是:制备无水SnCl4
实验原理是:Sn+2Cl2
(1)用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)________接________、________接________、________接________、________接________、________接________。
(2)装置Ⅵ的作用是___________;装置Ⅳ的作用是_____________。
(3)冷凝管理冷却水的流向是从__________进入,从__________流出。
(4)实验时应先点燃_____________处酒精灯,加热温度应大于______________℃,待__________即可停止加热。
(5)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为________。
(6)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是____________。
(7)为了防止污染空气,在装置的最后应____________。
分析:这是一个制备实验。
实验目的是:制备无水SnCl4
实验原理是:Sn+2Cl2  SnCl4
先制备Cl2:2H2SO4(浓)+2NaCl+MnO2
SnCl4
先制备Cl2:2H2SO4(浓)+2NaCl+MnO2  Na2SO4+MnSO4+Cl2↑+2H2O
实验的干扰因素是:SnCl4遇水强烈水解,因此,除去实验中水蒸气的干扰,是实验成败的关键。这里要分析水蒸气的来源以及除去水蒸气的措施。水蒸气的来自于制Cl2和空气中的水蒸气。
题目中提供的信息:SnCl4的性质在设计方案时要充分利用这些信息。
以上问题清楚了,实验方案就基本确定了。
答案:
(1)B接J,I接K,A接C,D接G,H接E(或F)
(2)除去Cl2中混有的HCl和水蒸气,在制Cl2时发生的副反应2NaCl+H2SO4
Na2SO4+MnSO4+Cl2↑+2H2O
实验的干扰因素是:SnCl4遇水强烈水解,因此,除去实验中水蒸气的干扰,是实验成败的关键。这里要分析水蒸气的来源以及除去水蒸气的措施。水蒸气的来自于制Cl2和空气中的水蒸气。
题目中提供的信息:SnCl4的性质在设计方案时要充分利用这些信息。
以上问题清楚了,实验方案就基本确定了。
答案:
(1)B接J,I接K,A接C,D接G,H接E(或F)
(2)除去Cl2中混有的HCl和水蒸气,在制Cl2时发生的副反应2NaCl+H2SO4  2HCl↑+Na2SO4,产生了HCl;防止空气中的水蒸气进入锥形瓶中使SnCl4发生水解。
(3)a、p (4)I 231℃ Sn粒熔化
(5)SnCl4+2H2O=SnO2+4HCl (6)出现白色烟雾
(7)通入NaOH溶液中,吸收多余Cl2
2HCl↑+Na2SO4,产生了HCl;防止空气中的水蒸气进入锥形瓶中使SnCl4发生水解。
(3)a、p (4)I 231℃ Sn粒熔化
(5)SnCl4+2H2O=SnO2+4HCl (6)出现白色烟雾
(7)通入NaOH溶液中,吸收多余Cl2
例2.为了测定工业纯碱中碳酸钠的质量分数(纯碱中常含少量NaCl),某学生设计了实验装置如图
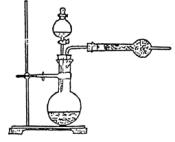 (1)准确称取盛有碱石灰的干燥管的质量(设为W1)
(2)准确称取一定量纯碱样品(设为W0),并放入烧瓶中。从分液漏斗缓缓滴入稀硫酸,待不再发生气体后。称干燥管的总质量(设为W2)。设学生导出的计算公式为:
Na2CO3的质量分数=
(1)准确称取盛有碱石灰的干燥管的质量(设为W1)
(2)准确称取一定量纯碱样品(设为W0),并放入烧瓶中。从分液漏斗缓缓滴入稀硫酸,待不再发生气体后。称干燥管的总质量(设为W2)。设学生导出的计算公式为:
Na2CO3的质量分数= 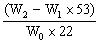 ×100%
试回答:
①W2-W1表示什么?
②如果不计称量误差,该生的实验结果有无明显误差?如有,是偏大还是偏小?请简要说明根据并提出补救措施。
分析:这是一道定量实验题
实验目的是:测定纯碱中 Na2CO3的质量分析
实验原理:稀H2SO4与Na2Cl3反应生成Cl2,测出CO2的质量即可求出Na2CO3的质量,继而求出Na2CO3的质量分数。
CO2的质量为(W2-W1)g,样品质量为W0g
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x W2-W1
x=
×100%
试回答:
①W2-W1表示什么?
②如果不计称量误差,该生的实验结果有无明显误差?如有,是偏大还是偏小?请简要说明根据并提出补救措施。
分析:这是一道定量实验题
实验目的是:测定纯碱中 Na2CO3的质量分析
实验原理:稀H2SO4与Na2Cl3反应生成Cl2,测出CO2的质量即可求出Na2CO3的质量,继而求出Na2CO3的质量分数。
CO2的质量为(W2-W1)g,样品质量为W0g
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x W2-W1
x= 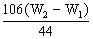 g
=
g
= 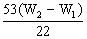 g
Na2CO3%=
g
Na2CO3%=  ×100%
产生误差的原因(即干扰因素)有烧瓶的CO2不能都被碱石灰吸收,实验值偏低。CO2气体混有的水蒸气和空气中的水蒸气被碱石灰吸收,使实验值偏高,两个因素综合考虑,CO2的影响是主要的,所以实验值偏低。
补救的办法:如图
×100%
产生误差的原因(即干扰因素)有烧瓶的CO2不能都被碱石灰吸收,实验值偏低。CO2气体混有的水蒸气和空气中的水蒸气被碱石灰吸收,使实验值偏高,两个因素综合考虑,CO2的影响是主要的,所以实验值偏低。
补救的办法:如图
 ①将蒸馏烧瓶改为集气瓶,利于排出CO2。
②向集气瓶中通入(已除去CO2)空气,用空气将烧瓶中Cl2尽量排出去。
③在干燥管前连接盛有浓H2SO4的试管,以除去水蒸气;
④在U型管中装有碱石灰,以吸收空气中的CO2气体,经过这些补救措施,实验误差可以降低。
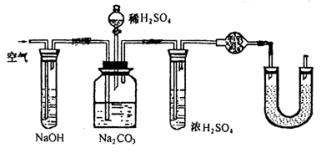
例3.实验室中用浓盐酸与MnO2制Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉,已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O,现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):
①将蒸馏烧瓶改为集气瓶,利于排出CO2。
②向集气瓶中通入(已除去CO2)空气,用空气将烧瓶中Cl2尽量排出去。
③在干燥管前连接盛有浓H2SO4的试管,以除去水蒸气;
④在U型管中装有碱石灰,以吸收空气中的CO2气体,经过这些补救措施,实验误差可以降低。
例3.实验室中用浓盐酸与MnO2制Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉,已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O,现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):
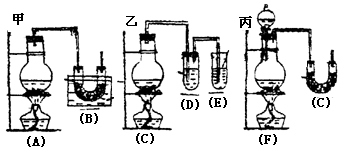 (1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内(错选、漏选、多选均倒扣分)
a.不易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.容易污染环境 f.可防止污染环境
(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内(错选、漏选、多选均倒扣分)
a.不易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.容易污染环境 f.可防止污染环境
|
1 |
优点 |
缺点 |
|
甲装置 |
1 |
1 |
|
乙装置 |
1 |
1 |
|
丙装置 |
1 |
1 |
(2)请从甲、乙、丙三装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流左到右方向)为_____________,在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,说明原因_____________________。 分析:这是一道评价实验方案的题。该题从是否有副反应发生,是否易控制反应速率,是否防止污染,是否干扰反应产物等方面进行评价。 答案: (1)优点 缺点 甲装置d a、e 乙装置f a、c 丙装置b e、c (2)F-B-E 在Cl2中混有HCl,应在烧瓶和凹形管之间连接一个盛有饱和食盐水的试管,以除去HCl气体。
3.中和滴定(选用)
①实验操作步骤(见基本操作)
②指示剂的选择原则
a.颜色变化由浅到深;b.指示剂变色范围和滴定混和液pH值相匹配;
③误差分析:
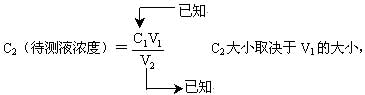 各种因素造成的误差最终通过V1表现出来,所以只要分析V1的大小来判断C2的大小。
ⅰ来自滴定管上产生的误差
盛标准液的滴定管用蒸馏水洗涤后未用标准液润洗(偏高)
盛待测液的滴定管用蒸馏水洗涤后未用待测液润洗(偏低)
盛标准液的滴定管滴定前有气泡,滴后无气泡(偏高)
盛待测液的滴定管滴定前有气泡,滴后无气泡(偏低)
锥形瓶用蒸馏水洗涤后又用待测液润洗(偏高)
ⅱ来自配制标准液产生的误差
配制0.1mol/L NaOH溶液500mL做为标准液。需要NaOH质量2g
NaOH已部分潮解(偏高)
NaOH中含有杂质,杂质不与待测液反应(偏高)
NaOH中所含杂质消耗1mol盐酸需质量大于40g(如含Na2CO3、NaHCO3)(偏高)
NaOH中所含杂质消耗1mol盐酸需质量小于40g(如含Na2O)(偏低)
ⅲ来自读数产生的误差
量取待测液时先俯视后仰视(偏低)先仰视后俯视(偏高)
测量标准液时先俯视后仰视(偏高)先仰视后俯视(偏低)
各种因素造成的误差最终通过V1表现出来,所以只要分析V1的大小来判断C2的大小。
ⅰ来自滴定管上产生的误差
盛标准液的滴定管用蒸馏水洗涤后未用标准液润洗(偏高)
盛待测液的滴定管用蒸馏水洗涤后未用待测液润洗(偏低)
盛标准液的滴定管滴定前有气泡,滴后无气泡(偏高)
盛待测液的滴定管滴定前有气泡,滴后无气泡(偏低)
锥形瓶用蒸馏水洗涤后又用待测液润洗(偏高)
ⅱ来自配制标准液产生的误差
配制0.1mol/L NaOH溶液500mL做为标准液。需要NaOH质量2g
NaOH已部分潮解(偏高)
NaOH中含有杂质,杂质不与待测液反应(偏高)
NaOH中所含杂质消耗1mol盐酸需质量大于40g(如含Na2CO3、NaHCO3)(偏高)
NaOH中所含杂质消耗1mol盐酸需质量小于40g(如含Na2O)(偏低)
ⅲ来自读数产生的误差
量取待测液时先俯视后仰视(偏低)先仰视后俯视(偏高)
测量标准液时先俯视后仰视(偏高)先仰视后俯视(偏低)
2.硫酸铜晶体中结晶水含量的测定
①实验操作步骤:称量坩埚质量(W1),装入适量硫酸晶体铜,再称量坩埚和硫酸铜晶体的总质量(W2)。充分加热直到晶体变为白色粉末。在干燥器内冷却至室温,再称量无水硫酸铜及坩埚的总质量(W3)。重复操作,直到称量的W3的误差小于0.1克
结晶水的含量= 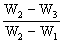 ×100%
②误差分析:
测定值偏高的原因有:原晶体不干燥,带有少量水;加热时温度过高,有CuO出现;晶体中含受热易分解的杂质;加热时少量晶体溅出坩埚。
测定值偏低的原因有:加热不充分,硫酸铜晶体中还存在结晶水;加热后的白色粉末在空气中放置冷却;晶体中含受热不分解、有挥发的杂质。
×100%
②误差分析:
测定值偏高的原因有:原晶体不干燥,带有少量水;加热时温度过高,有CuO出现;晶体中含受热易分解的杂质;加热时少量晶体溅出坩埚。
测定值偏低的原因有:加热不充分,硫酸铜晶体中还存在结晶水;加热后的白色粉末在空气中放置冷却;晶体中含受热不分解、有挥发的杂质。
(二)非选择题
1.根据从草木灰中提取钾盐的实验,填写下列空白:
(1)此实验操作顺序如下:①称量样品 ②溶解沉降 ③ ④
⑤冷却结晶。
(2)用天平(托盘天平、指针向上)称量样品时,若指针偏向右边则表示(填代码)
A.左盘重,样品轻 B.左盘轻,砝码重
C.左盘轻,砝码轻 D.右盘轻,样品重
(3)在进行第③步操作时,有时可能要重复进行,这是由于 。
(4)在进行第④步操作时,要用玻棒不断小心地搅动液体,目的是防止
(5)所得产物中主要的钾盐有:
2.实验室制备硝基苯的主要步骤如下:
①配制一定比例浓硝酸与浓硫酸的混合酸,加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50-60℃下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例浓硫酸和浓硝酸混合酸时,操作注意事项是 。
(2)步骤③中,为使反应在50-60℃下进行,常用的方法是 。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是 。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是 。
(5)纯硝基苯是无色,密度比水 (填“大”或“小”),具有 气味的油状液 体。
3.为了测定人体新陈代谢呼出气体中CO2,准确测量瓶Ⅰ中溶液吸收CO2的体积分数,某学生课外小组设计了如右图的实验 装置。实验中用过量NaOH溶液吸收气体中的CO2后的增重及剩余气体的体积(实验时只用嘴 吸气和呼气),请填空:
(1)图中瓶Ⅱ的作用是 。
(2)对实验装置尚有如下A、B、C、D四种建议,你认为合理的是(填代号) 。
A.在E处增加CaCl2干燥管
B.在F处增加CaCl2干燥管
C.在E和F处增加CaCl2干燥管
D.不必增加干燥管
(3)将插入溶液的管子下端改成具有多孔的球泡(图中的Ⅲ),有利于提高实验的准确度,其理由是 。
(4)实验时先缓慢吸气,再缓慢呼气,反复若干次,得如下数据:瓶Ⅰ溶液增重a g,收集到 的气体体积(标准状况)为b L,该呼出气体中CO2的体积分数是(列出算式):
(5)实验中若猛吸猛呼,会造成不安全后果,猛吸时会 ,猛呼时会 。
4.已知乙醇和氯化钙反应生成微溶于水的CaCl2·6C2H5OH。有关的有机试剂的沸点如下:CH3COOC2H5 77.1℃;C2H5OH 78.3 ℃,C2H5OC2H5(乙醚)34.5℃; CH3COOH 118℃。实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇与 少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏。得到含有乙醇、乙醚、 醋酸和水的乙酸乙酯粗产品。
(1)反应中加入的乙醇是过量的,其目的是 。
(2)边滴边醋酸,加边热蒸馏的目的是 。
将粗产品再经下列步骤精制:
(3)为除去其中的醋酸,可向产品中加入(填字母) 。
A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠
(4)再向其中加入饱和氯化钙溶液,振荡、分离。其目的是 。
(5)然后再向其中加入无水硫酸钠,振荡,其目的是 。最后,将经过上述处理后的液体加入另一干燥的蒸馏瓶内,再蒸馏弃去低沸点馏分,收集沸程76 -78℃之间的馏分即得。
5.溴乙烷的沸点是38.4℃,密度是1.46g/cm3。图为实验室制备溴乙烷的装置示意图,A- 水浴加热装置,B-分馏柱,C-温度计,F-接液管,G-中盛蒸馏水。
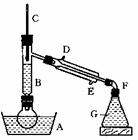
在圆底烧瓶中依次加入溴化钠、适量水、95%乙醇和浓H2SO4。边反应边蒸馏,蒸出的溴乙烷用水下收集法获得。反应:
NaBr+H2SO4 NaHSO4+HBr
NaHSO4+HBr
C2H5OH+HBr C2H5Br+H2O
C2H5Br+H2O
可能发生的副反应:
H2SO4(浓)+2HBr Br2+SO2+2H2O
Br2+SO2+2H2O
(1)反应中要加入适量水,除为了溶解NaBr外,还起到以下作用:① ,② 。
(2)反应采用水浴加热是为了:①反应容器受热均匀,② 。温度计显示的温度最好 控制在 ℃,这是因为 。
(3)分馏柱的作用是:①使溴乙烷馏出,② 。
(4)反应采取边反应边蒸馏的操作设计,主要是为了 。
(5)溴乙烷可用水下收集法获得的根据是 ,接液管口 恰好没入液面的理由是 。冷凝水应从 进入冷疑管。
6.某碱式碳酸铜是孔雀绿固体绿沫,其组成可表示为:Cu2(OH)2CO3·xH2O, 在加热条件下,它失去结晶水的同时发生分解,反应的化学方程式是Cu2(OH)2CO3·x H2O 2CuO+CO2+(x+1)H2O.取一定量该固体样品,不准确称量其质
量,用两套仪器装置,先后进行两个实验。实验(Ⅰ)测定该碱式碳酸铜粉末组成中结晶水x 的值;
2CuO+CO2+(x+1)H2O.取一定量该固体样品,不准确称量其质
量,用两套仪器装置,先后进行两个实验。实验(Ⅰ)测定该碱式碳酸铜粉末组成中结晶水x 的值;
实验(Ⅱ)用实验(Ⅰ)结束后的残留固体与乙醇蒸气反应,并检验反应产物。
试回答下列问题:
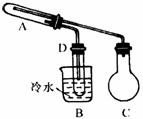
(1)现已装配好一套仪器装置(如图),其中装置中的铁架台、铁夹、铁圈、酒精灯、 石棉网在图中均已略去,这套装置用于完成上述实验 (填标号)。
(2)用下面的仪器(必要的铁架台、铁夹、酒精灯均在图中略去)组装完成另一个实验,组装 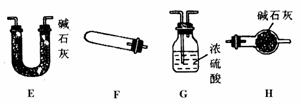
时仪器按气流方向从左到右连接的顺序是 → → → (填装置对应字母)。
在这套实验装置中,干燥管H的作用是
(3)实验开始时,碱式碳酸铜放在仪器(填装置对应字母) 中,乙醇放在仪器(填装置对应字母) 中。
(4)这两套装置中,在实验时需要加热的仪器是(填字母) 。
(5)实验结束后可见试管D的内壁有银白色金属析出,实验中试管A内发生的反应的化学方程 式是 ;从试管A通入试管D的导管中气体的成分是(名称,水蒸气不必写) 。
(6)这两套装置中,在实验前后均要连同所盛试剂一起准确称量的仪器是(填字母) 若用托盘天平称量,其中某次称量记录的数据是51.12 g,这样的记录是否合理 (填 “合理”或“不合理”)
7.用NH3还原CuO的方法测定铜的近似相对原子质量,其反应为:2NH3+3CuO N2+3Cu+3H2O.试回答:(1)若反应物CuO和生成物H2O的质量为m(CuO)、m(H 2O)选用下列仪器设计一个简单的实验方案。
N2+3Cu+3H2O.试回答:(1)若反应物CuO和生成物H2O的质量为m(CuO)、m(H 2O)选用下列仪器设计一个简单的实验方案。
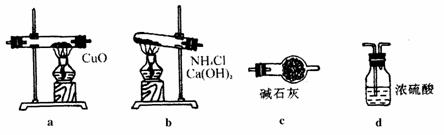
①仪器连接的顺序(用字母编号表示,仪器可重复使用) ,d中浓硫酸的作用是 ;
②列出计算Cu相对原子质量的表达式 ,实验完毕时观察到a中的现象是 ;
③下列情况将使测定结果偏大的是 。(a)CuO未完全还原为Cu (b)CuO受潮 (c)CuO中 混有Cu
(2)若仍采用上述仪器装置,用其他方案可测定的物理量有( )
(a)m(Cu)和m(CuO) (b)m(N2)和m(H2O)
(c)m(Cu)和m(H2O) (d)m(NH3)和m(H2O)
8.根据实验室中测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写) 。
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚 H.干 燥器 I.石棉网 J.三脚架
除上述仪器外,还需要的仪器是 。
(2)某学生实验后得到以下数据:
|
加热前质量 |
加热后质量 |
|
|
W1(容器) |
W2(容器+晶体) |
W3(容器+无水硫酸铜) |
|
5.4 g |
7.9 g |
6.8 g |
请写出结晶水含量(x%)的计算公式(用W1、W2、W3表示)x%= 。
该生测定结果是偏高还是偏低?
从下列分析中选出该学生产生实验误差的原因可能是(填写字母) 。
A.加热前称量时容器未完全干燥
B.最后两次加热后的质量相差较大(大于0.1 g)
C.加热后容器未放入干燥器中冷却
D.加热过程中晶体有少量溅失
9.氯化铜晶体(CuCl2·2H2
O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其 制成水溶液,然后按下图所示的操作步骤进行提纯:
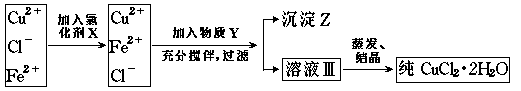
(1)为什么加入氧化剂X? 。
(2)下列物质都可以作为氧化剂,其中最适宜于本实验的是( )
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
(3)物质Y是 ,沉淀Z是 。
(4)为分离出沉淀Z,蒸发溶液Ⅲ,获得晶体,请选择所需的仪器是 。
(A)漏斗;(B)烧杯;(C)试管;(D)蒸发皿;(E)坩埚;(F)温度计;(G)酒精灯;(H)铁架台( 附铁圈);(I)滴管;(J)锥形瓶。除以上仪器外还需要的仪器和实验用品是 。
10.用滴管将新制的饱和氯水慢慢滴入含酚酞的氢氧化钠溶液(样品)中,当滴到最后一滴时 红色突然褪去。产生该现象的原因可能有两个:
(1)是由于 (简要文字说明)
(2)是由于 (简要文字说明)
简述怎样用实验证明红色褪去的原因是(1)或者是(2)。
11.海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里 从海带中提取碘的流程如下:
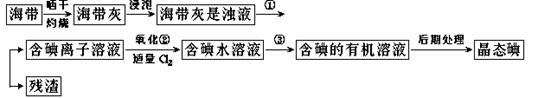 (1)指出提取碘的过程中有关的实验操作名称:①
,③
。
(1)指出提取碘的过程中有关的实验操作名称:①
,③
。
写出过程②中有关反应的离子方程式: 。
(2)提取碘的过程中,可供选择的有机试剂是( )。
A.甲苯、酒精 B.CCl4、苯
C.汽油、乙酸 D.裂化气油、苯
(3)为使海带灰中碘离子转化为碘的有机溶液,实验室里的烧杯、玻棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器和物品,仍缺少的玻璃仪器 。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏过程。指出下列蒸馏实验 装中的错误(出下图)
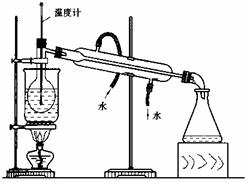
① ,② ,③ 。
(5)进行蒸馏操作时,使用水浴的原因是 。最后晶体碘在 里聚集。
12.下图是测定含两种元素的某种气体X的化学式的实验装置
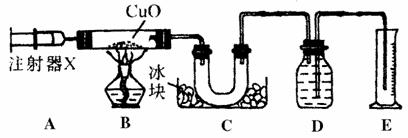
实验过程及现象如下:某温度下,将装置A中的X气体缓慢通过已排尽空气并装有CuO的装置B ,反应后装置B中黑色粉末变成红色光亮粉末,装置C中收集到水,D中收集到N2。
(1)实验中测定X反应了240 mL,装置E中收集到240 mL水,氧化铜质量减少了0.32 g,且测得在该温度下,1molX气体的体积为24000mL,则X的摩尔质量为 (g/mol),X的化学式为 。
(2)B中发生反应的化学方程式(设X在此条件下不分解)是:
13.用下图中的简易装置可以进行气体的发生和收集实验:
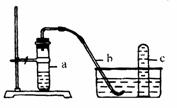
(1)实验前应如何检查该装置的气密性?
(2)拔开试管a的橡皮塞,加入10 mL 6 mol/L稀硝酸和1 g薄铜片,立即将带有导管的橡皮塞塞紧试管口。反应开始时速度缓慢,逐渐加快。请写出试管a中所发生的所用反应的化学方程式。
(3)从反应开始到反应结束,预期在试管a中可观察到哪些现象?请依次逐一写出。
(4)在反应开始时,可观察到导管b中的水面先沿导管b慢慢上升到一定高度,此后又回落, 然后有气泡从管口冒出。试说明反应开始时,导管中水面上升的原因。
(5)试管c收集满气体后,用拇指堵住管口,取出水槽。将试管向上,松开拇指,片刻后,再 次堵住管口,将试管又再倒置于水槽中,松开拇指,此时可观察到什么现象?
14.实验室用下图中所示装置进行苯与溴反应的实验
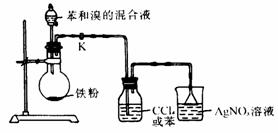
(1)由分液漏斗往烧瓶中滴加苯与溴的混合液时,反应十分剧烈,放出热量,可明显观察到烧瓶中充满了 色气体。
(2)若装置中缺洗气瓶,则烧杯中产生的现象无法说明苯与溴的反应是取代反应,其理由是
(3)实验完毕,关闭K,由分液漏斗往烧瓶中加NaOH溶液,加NaOH溶液的目的是
① 。
② 。
15.实验室常见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置简单、操作方便、现象明显、可反复使用等优点.
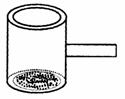
(1)用此仪器不能反复进行的实验是
A.NH4Cl受热分解的实验
B.KMnO4受热分解的实验
C.白磷和红磷在一定温度下相互转变的实验
D.无水CuSO4与胆矾的互变实验
(2)当玻璃管内装有NO2与N2O4的混合气体时,亦可反复进行反应条件对化学平衡影响的实验,该实验的操作过程和实验现象是:
16.(1)实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,反应式为:
NaNO2+NH4Cl=NaCl+N2↑+2H2O↑+Q
实验装置如图所示,试回答:
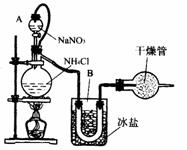
(1)①装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是 (填写编号)
a.防止NaNO2饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2饱和溶液容易滴下
②B部分的作用是
a.冷凝 b.冷却氮气 c.缓冲氮气流
③加热前必须进行一个操作步骤是 ,加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 .
④收集N2前,必须进行的步骤是(用文字说明) .收集N2最适宜的方法是(填写编 号) .
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中 c.直接收集在球胆或塑料袋中
(2)实验室合成氨装置如下图所示,试回答
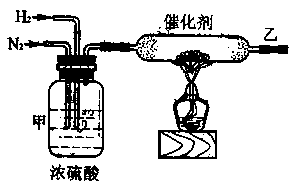
装置甲的作用是:① ;② ;③
从乙处导出的气体是 ,检验产物的简单化学方法是 .
17.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、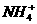 、Cl-、Mg2+、Fe3+、
、Cl-、Mg2+、Fe3+、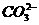 、
、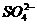 ,现每次取100.0mL进行实验 。
,现每次取100.0mL进行实验 。
(1)第一份加入AgNO3溶液有沉淀产生。
(2)第二份加足量NaOH后加热,收集到气体0.896L(标准状态下)。
(3)第三份加足量BaCl2后,得沉淀6.72g,沉淀经足量盐酸洗涤后,剩2.33g。
试回答有关问题:
①判断K+、Cl-是否存在?K+ Cl- (填下列序号)
A.一定存在 B.可能存在 C.一定不存在
②肯定存在的离子的原溶液中的物质的量浓度分别为 。
18.从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图。
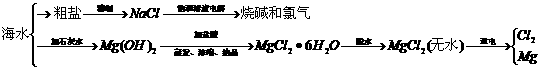
根据示意图回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、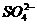 等杂质离子,精制时所用试剂为盐
酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂的顺序是
。
等杂质离子,精制时所用试剂为盐
酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂的顺序是
。
(2)电解饱和食盐水的总反应的化学方程式为 。
(3)工业上MgCl2·6H2O晶体在 气氛中加热脱水,通入此种气体的作用是 。
可选用药品:MgCl2·6H2O晶体、NaCL(s)、KClO3(s)、MnO2、浓H2SO4、浓HCl 、稀NaOH溶液。
仪器:见下图(装置可重复使用)。
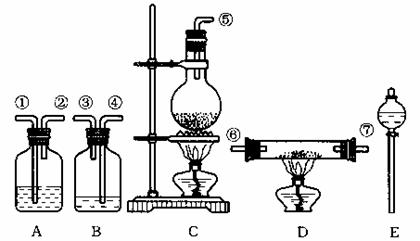
组装氯化氢气体发生器,应选用的仪器(用编号A、B、…填入)是 ;有关的化学方程式是 。
按HCl气流方向,其余装置的连接顺序(用数字①、②…填入)是:
( )?( )( )?( )( )?( )( )
各装置中应放的药品为:A. ,B. ,C. ,D. ,E. 。
B装置的作用是 ,B中能观察到的现象是 。
19.化合物SOCl2是一种液态化合物,沸点77℃,在盛有10mL 水的锥形瓶中小心地滴加8 -10滴SOCl2,可观察到反应剧烈,液面上有白雾形成,并逸出刺激性气味的气体,该气体可使沾有品红试液的滤液褪色。轻轻振荡锥形瓶,待白雾消失后往溶液中滴加AgNO3溶液,有不溶于稀硝酸的白色沉淀析出。
(1)根据以上实验,写出SOCl2与水反应的化学方程式:
(2)由于ZnCl2溶液蒸干灼烧后得不到ZnCl2固体,只能得到Zn(OH)Cl,所以工业上往往用ZnCl2·3H2O和SOCl2混合后共热来制取无水氯化锌,写出该种制法可行性的原因: 。
(3)SOCl2还能和某些含羟基的化合物反应,如它能和乙醇起反应,可表示为 。和 上述反应相似,当过量的SOCl2和苯甲酸混合后,稍微加热即发生反应,苯甲酸完全转化 为一种沸点为197℃的液态有机物,该反应的化学方程式可表示为: 。
(4)为了使生成的有机物与混溶在其中的过量的SOCl2分离,可采用下列的哪种操作方法?
A.过滤 B.分液 C.蒸发结晶 D.蒸馏
(一)选择题
1.用pH试纸测定某无色溶液的pH时,规范的操作是( )
A.将pH试纸放入溶液中观察其颜色的变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴到pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色变化,跟标准比色卡比较
2.实验室保存下列药品的方法,正确的是( )
A.氢氟酸贮存在特制的塑料瓶里
B.盛放浓硫酸的广口瓶应当用磨口玻璃塞,不能用橡皮塞
C.盛溴的试剂瓶里加一些水来防止溴挥发
D.在同一层药品橱里存放浓氨水和浓盐酸
3.今有下列实验:①为加快细铜丝和硫蒸气的反应,先将铜丝进行灼烧;②将0.01 mol/L-1KI溶液8-10滴,滴入10 mL相同浓度的硝酸银溶液中,可制取碘化银胶体;③2%氢氧化钠溶液4-6滴,滴入10%CuSO4溶液2 mL中制取Cu(OH)2悬浊液,可直接用于检验醛基;④将等体积乙醇和浓硫酸混合共热制乙烯。上述实验方法中( )
A.①②正确 B.②③正确 C.都正确 D.都不正确
4.关于某溶液中所含离子的鉴别,下列判断正确的是( )
A.加入AgNO3溶液生成白色沉淀,加稀盐酸沉淀不消失,则一定有Cl-存在
B.加入NaOH溶液能生成白色沉淀,NaOH过量时沉淀又消失,则原溶液一定有Al3+
C.加入NaOH并加热有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液一定有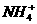
D.加入盐酸有能使澄清石灰水浑浊的气体生成,则原溶液一定有大量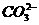
5.按下列过程,最终目的能实现的是( )
A.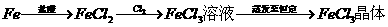
B.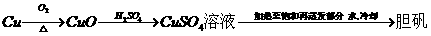
C.镀锌铁皮刻痕上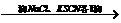 几秒后刻痕处显红色
几秒后刻痕处显红色
D.醋酸溶液中加入烧碱溶液至pH=7 醋酸钠晶体
醋酸钠晶体
6.下列实验中,仪器上端必须插入液面的是( )
①制备氢气的简易装置中的长颈漏斗;
②制备氯气装置中的分液漏斗;
③制备Fe(OH)2操作中的胶头滴管;
④将氯化氢气体溶于水时的导气管;
⑤用乙醇制取乙烯时的温度计;
⑥蒸馏石油时的温度计。
A.①③⑤ B.②④⑥ C.①③④⑤ D.全部
7.假冒羊毛织物欺骗了消费者,用灼热方法可以区别羊毛织物、棉织物和化纤织物。下列 灼烧产生的现象说明灼烧物为羊毛织物的是( )
①有焦羽毛味 ②有芹菜味 ③接近火焰迅速卷缩 ④灰烬呈灰褐色球状,不易破碎 ⑤灰 烬为带有光泽的硬球,易破碎 ⑥灰烬为黑色粉末
A.①③ B.②④ C.①⑤ D.③⑥
8.对下列定量实验中的基本操作和仪器的描述正确的是( )
A.用托盘天平称取0.5 mol NaOH固体20.0 g
B.将用水润湿的pH试纸,浸入稀盐酸溶液,测定溶液的pH
C.滴定管的0刻度线在上部,而量筒的0刻度线在下部
D.在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,此时无须再加入蒸馏水使其液面与刻度持平
9.以Al、稀H2SO4和NaOH为原料制取Al(OH)3,甲、乙、丙3个学生分别用3种不同的途径制备:
甲:Al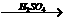 Al2(SO4)3
Al2(SO4)3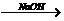 Al(OH)3
Al(OH)3
乙:Al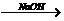 NaAlO2
NaAlO2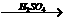 Al(OH)3
Al(OH)3
丙: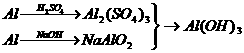
若要制得等量的Al(OH),则( )
A.乙消耗原料最少 B.三者消耗原料相同
C.丙消耗的原料最少 D.甲、乙消耗原料相同
10.欲从苯酚的乙醇溶液中回收苯酚,有下列操作:①蒸馏;②过滤;③静置分液;④加入足量金属钠;⑤通入过量的CO2;⑥加入足量的NaOH溶液;⑦加入足量的FeCl3溶液;⑧加入乙酸与浓酸混合液加热。合理的步骤程序是( )
A.④⑤③ B.⑥①⑤③ C.⑧① D.⑧②⑤③
11.当中和滴定接近终点时,下列操作错误的是( )
①应注视滴定管内液面的变化
②应注视滴定管中溶液流出的速度
③应注视锥形瓶中指示剂颜色的变化
A.①和② B.②和③ C.只有① D.只有②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com