
题目列表(包括答案和解析)
2.生活中碰到的某些问题常常涉及到化学知识,下列叙述不正确的是
A.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
B.家用消毒液发生器其原理是用石墨作电极电解饱和氯化钠溶液,制得有较强杀菌能力的消毒液
C.血液是由血球在血浆中形成的胶体,因而肾功能衰竭的病人血液中的毒素可以通过透析的方法除去
D.蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打溶液或稀氨水
1.2003年2月1日,美国哥伦比亚号航天飞机在空中解体失事,有专家分析认为,飞机空中解体的最大可能原因是航天飞机机壳底部的石墨瓦在空中脱落,击中机翼。航天飞机表面覆盖石墨瓦,主要是利用石墨
A.具有导电性,防辐射
B.密度小,减轻机身重量
C.熔点高,化学性质稳定
D.硬度小,有润滑作用
27.(5分)甲醇是一种重要的醇,它可以做内燃机的燃料和溶剂,也是一种重要的化工原料,同时它在废水处理中也有重要应用。甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2+NH3===NO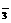 +H++H2O,
6NO
+H++H2O,
6NO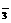 +6H++5CH3OH
+6H++5CH3OH 3N2↑+5CO2↑+13H2O
3N2↑+5CO2↑+13H2O
若某废水用上述方法处理时,NH3→NO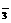 的转化率为95%,NO
的转化率为95%,NO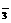 →N2的转化率为86%。若每天处理此种含NH3为34 mg/L的废水500 m3(密度1 g/cm3)需要甲醇多少kg?(保留至小数点后一位)
→N2的转化率为86%。若每天处理此种含NH3为34 mg/L的废水500 m3(密度1 g/cm3)需要甲醇多少kg?(保留至小数点后一位)
※28.(11分)用废铁屑与稀硫酸反应,可制得硫酸亚铁。在10℃和50℃时,FeSO4在 100 g水中的溶解度分别为20.5 g和 48.6 g。现取 200 mL 0.500 mol/L H2SO4溶液,将 8.00 g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约15 min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4·7H2O晶体。
(1)滤液中除 FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是 ;它是由 而产生的,其检测的方法 。
(2)设 H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至 50℃时,溶液的体积约为50.0 mL,该溶液是否达饱和?试通过计算加以说明。(50℃时,FeSO4饱和溶液的密度为1.36 g/cm3)
(3)设 H2SO4与铁完全反应,计算在80℃下将溶液蒸发至体积为50.0 mL,再冷却至10℃时,所得到的FeSO4·7H2O的质量。( 80℃时溶液的密度:1.30 g/cm3。本大题计算结果保留3位有效数字)
26.(8分)以苯为主要原料合成一种除草剂E,合成路线如下所示,部分产物及反应条件已略去。
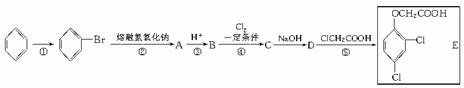
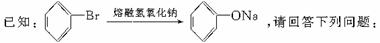
(1)完成反应①所需的试剂及反应条件为 。
(2)有机物D的结构简式为 。
(3)反应③的离子方程式为 ;反应④的化学方程式为 ,其反应类型为 。
25.(10分)根据下面物质间转换的框图,回答有关问题:
(1)写出框图中D、E的电子式:D ;E 。
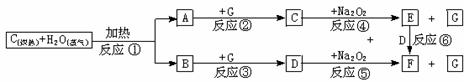
(2)如果2 mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是 L,同时反应中转移电子总数是 NA(NA表示阿佛加德罗常数)。
(3)请设计一个课堂小实验,证实反应⑤是放热反应。
(4)如果A、B混合气体7.8 g(平均摩尔质量10 g·mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重 g,并得到O2 mol。
23.(6分)已知有如下反应:

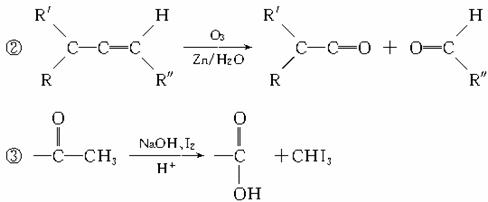
根据以下转化过程填空:
 写出下列有机物结构简式:A
,B
,C
,D
,E
,F
。
写出下列有机物结构简式:A
,B
,C
,D
,E
,F
。
※24.(4分)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu===2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-===Cu2+;还原反应为:2Fe3++2e-===2Fe2+。
(1)请据此将反应3NO2+H2O===2H++2NO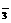 +NO拆写为两个半反应式。
+NO拆写为两个半反应式。
氧化反应 ;
还原反应 。
(2)已知某一反应的半反应式CH4+10OH--8e-===CO +7H2O,O2+2H2O+4e-===4OH-。则总方程式为
。
+7H2O,O2+2H2O+4e-===4OH-。则总方程式为
。
22.(8分)用下图装置(酒精灯、铁架台等没有画出)制取三氯化磷。在d中放入足量的白磷,将氯气迅速而不间断地通入d中,氯气与白磷就会发生反应,产生火焰。其三氯化磷和五氯化磷的物理量如下:
熔点 沸点
三氯化磷 -112℃ 76℃
五氯化磷 148℃ 200℃分解

(1)若在b中装入MnO2,则a中应装入 。
(2)在g中盛放冷水的目的是 。
(3)PCl3遇水剧烈反应,c中装入的物质是 。
(4)先在d中底部放入少量细砂,然后放入完全除去了水分的白磷。为什么要在d中放人少量细砂? 。
(5)f中碱石灰的作用是 。
(6)如果要除去Cl2中的HCl,实验装置应作何改进?
。
21.(8分)在下图中,当容器A中的反应开始后,再进行下列操作:
(1)若弹簧止水夹C打开, B容器中有什么现象发生? 。
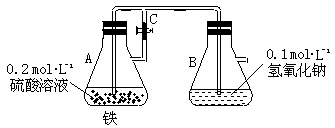
(2)若止水夹C关闭一段时间后,而容器A中的反应仍在进行时,B中有什么现象发生? ,写出B中有关反应的化学方程式 。
(3)若先打开止水夹 C一段时间,让 A中的反应进行,然后再关闭止水夹 C一会儿,B中所发生的现象是 。其原因是 。
19.NA表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,17 g氨气的体积恰好是22.4 L
B.标准状况下,2.8 L辛烷完全燃烧生成气态产物分子数为NA
C.2 g重氢气(D2),在标准状况所含原子个数为2NA
D.常温、常压下,32 g氧气与34 g硫化氢分子数之比为1∶1

※20.菲的结构简式可表示为: ,若菲分子中有2个H原子被Cl原子取代,
则所得二氯取代产物有
A.5种 B.15种 C.20种 D.25种
第Ⅱ卷(非选择题?共8题?共60分)
18.用铂电极持续电解下列溶液(电流强度不变),阳极上产生气体的量可能发生下图所示变化的是

A.KI溶液 B.Na2SO4溶液
C.CuSO4溶液 D.NaCl溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com