
题目列表(包括答案和解析)
23.(6分)中国是《日内瓦协定书》的缔约国,2003年12月3日,发表了《中国的防扩散政策和措施》白皮书,重申反对使用化学武器,反对任何形式的化学武器扩散。苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式如右图所示:
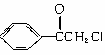
(1)苯氯乙酮不可能具有的化学性质是__________(填序号)。
A.加成反应 B.取代反应
C.消去反应 D.水解反应
E.银镜反应
(2)与苯氯乙酮互为同分异构体,且能发生银镜反应,分子有苯环但不含-CH3的化合物有多种,请举出两例,写出它们的结构简式。(这两例分子内必须含有不同的基团)
22.(6分)2000年10月10日,诺贝尔化学奖授予美国科学家艾伦·黑格、艾伦·马克迪尔米德和日本科学家白川英树,以表彰他们有关导电聚合物的发现。他们研究发现:经过改造后的塑料能够像金属一样表现导电性能。以聚乙炔为例,要使其能够导电,必须用I2或Na等做掺杂处理,他们用碘做的掺杂实验通式如下:
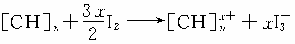
回答下列问题:
(1)聚乙炔的碳链结构片段可表示为__________。
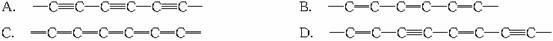 (2)下列叙述正确的是__________。
(2)下列叙述正确的是__________。
A.这种可导电的塑料是一种纯净物,有固定的熔、沸点
B.掺杂后的聚乙炔所以可导电,是因为它具有类似盐的结构
C.聚乙炔和碘的掺杂反应中,聚乙炔被还原
D.聚乙炔经掺杂反应后,分子内碳链结构未发生变化
(3)试写出用钠做掺杂实验的通式_________________。
21.(8分)乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
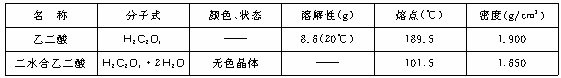 注:表中“--”是尚未有具体数据。
注:表中“--”是尚未有具体数据。
回答下列问题:
(1)向盛有Na2CO3粉末的试管里加入约3 mL乙二酸溶液,观察到的现象为__________;说明乙二酸的酸性比碳酸__________。
(2)向盛有5 mL乙二酸饱和溶液的试管中滴入3滴硫酸酸化的0.5%(质量分数)的KMnO4溶液,振荡,观察到的现象为__________;说明乙二酸有__________性。
(3)已知草酸分解的化学方程式为H2C2O4 H2O+CO2↑+CO↑。为了验证草酸受热分解及其产物,用右图装置进行实验,加热草酸晶体,有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出用该装置进行实验可能存在的四个不合理的主要原因。
H2O+CO2↑+CO↑。为了验证草酸受热分解及其产物,用右图装置进行实验,加热草酸晶体,有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出用该装置进行实验可能存在的四个不合理的主要原因。

答:①_____________________________________________;
②_____________________________________________;
③_____________________________________________;
④_____________________________________________。
20.(8分)铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同。
某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如下图所示的实验装置。实验步骤如下:
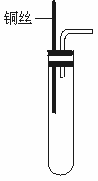
①检查装置的气密性;
②向试管中加入一定量碳酸钙固体;
③向试管中倒入过量的稀硝酸,并迅速盖上带铜丝和导管的橡皮塞;
④待反应完全后,将导管插入试管内接近液面;
⑤将铜丝插入到溶液中;
⑥用注射器向试管内推入氧气(或空气)。
请回答下列问题:
(1)实验中加入CaCO3的作用是__________________________。
(2)实验中推入氧气或空气的目的是__________________________。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异的结果,你同意这种看法吗?__________(填“同意”或“不同意”),原因是__________________________;另一同学提出溶液呈“绿色”是Cu2+与NO2混合的结果,请你设计一个实验证明之。(简述实验方案和实验现象)__________________________。
19.(7分)据下列信息完成所需回答的问题:
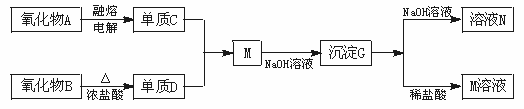
其中氧化物A是白色固体;氧化物B是黑色固体;单质C不溶于冷的浓硝酸。
(1)D是__________;G是__________。(填化学式)
(2)元素C位于周期表中第__________周期__________族。
(3)写出下列反应的离子方程式
B+浓盐酸_____________________________。
G+NaOH溶液___________________________。
(4)单质C不与冷的浓硝酸反应的原因是__________________________。
18.(5分)已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序为__________(填编号)。
(2)若上述关系中③是正确的,则溶液中的溶质为__________。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH)__________c(CH3COOH)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是c(H+)__________c(OH-)。
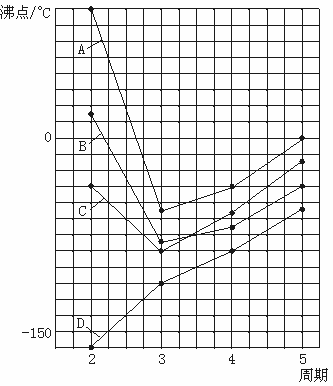
17.(8分)下图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素气态氢化物沸点的是曲线__________;表示?ⅣA?族元素气态氢化物沸点的是曲线__________;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是__________________________;A、B、C曲线中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因是________________________。
16.向Cr2(SO4)3的水溶液中,加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO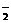 )。其平衡关系如下:
)。其平衡关系如下:
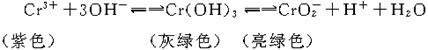
向0.05 mol·L-1的Cr2(SO4)3溶液50 mL中,加入1.0 mol·L-1的NaOH溶液50 mL,充分反应后,溶液中可观察到的现象为
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
绝密 ★ 启用前 (四月号)
全国统一标准测试
化 学 (B卷)
第Ⅱ卷(非选择题 共9题 共60分)
15.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是

A.有O2进入发生反应的a极为电池的负极
B.有H2进入发生反应的b极为电池的正极
C.a极对应的电极反应为:O2+2H2O+4e-====4OH-
D.该电池的总反应方程式为:2H2+O2 2H2O
2H2O
14.在相同条件下(T=500 K),相同体积的甲、乙两容器中,甲充入1 g SO2、1 g O2,乙充入2 g SO2、2 g O2,下列叙述中错误的是
A.化学反应速率:乙>甲
B.SO2转化率:乙>甲
C.平衡后O2浓度:乙>甲
D.平衡后SO2的体积分数:乙>甲
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com