
题目列表(包括答案和解析)
51、将1.05 g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加 入50 mL 1 mol·L-1的盐酸,可恰好使反应过程中产生的沉淀刚好消失。求原混合物中铝、过氧化钠各多少克?
50、氧化二氯是棕黄色刺激性气体,熔点:-116℃,沸点:3.8℃。氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1:100),同时反应生成次氯酸溶液。制备出之后要冷却成固态以便操作和贮存,制备少量Cl2O,是用干燥的氯气和HgO反应(还生成HgO•HgCl2)。装置示意如图,铁架台和夹持仪器已略去)
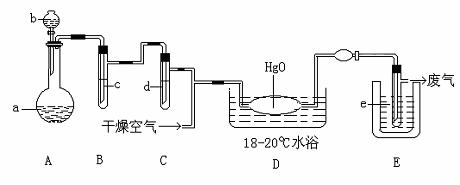
(1)A中盛有的固体深色试剂a是 ,分液漏斗中试剂b是
(2)B中盛有液体c是 ,C中的液体d是
(3)D中所发生反应的化学方程式是
(4)E中的保温瓶中盛有致冷剂,它应是 (在干冰、冰水、液态空气中选择),
在E的内管得到的氧化二氯中可能含有杂质是
(5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是
,用这些不同的连接方式的主要理由是 。
49、科学家制造出了一种神奇塑料,它能自动愈合自身内部的细微裂纹,即具有自我修复功能,它是由液态二环戊二烯和一种催化剂合成的,试根据以下信息回答有关问题:
信息一:烯烃可以发生双烯合成。
CH2=CH-CH3+CH2=CH2→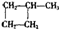 (简写为
(简写为 )
)
信息二:CH2=CH-CH=CH2与HBr反应的化学方程式为:
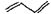 +HBr→
+HBr→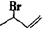 +
+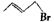
20% 80%
环戊二烯在双分子合成时一个发生1,2一加成,另一个就发生1,4-加成。
信息三:“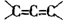 ”极不稳定。
”极不稳定。
信息四:
A 二环戊二烯 神奇塑料
问题:(1)写出A和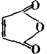 反应的化学方程式,并指出1mol产物最多能消耗多少克NaOH,写出产物和Cl2发生加成反应的产物的结构简式。
反应的化学方程式,并指出1mol产物最多能消耗多少克NaOH,写出产物和Cl2发生加成反应的产物的结构简式。
(2)写出A→B、B→C的化学方程式,并指出B→C的反应类型。
(3)写出A的所有开链不饱和烃的同分异构体。
(4)科学家看到人的身体受到伤害流血结痂的过程而想到制备出这种神奇塑料,这种原理我们称之为 学。
48、金属M可以在不同条件下发生下列五个反应:
M+A→I;M+B→H;M+C→H+F;M+D→H+A;M+E→I+G,其中:
①A、B、C、D在通常状况下都是气体,并知C是CO2;②上述反应的产物,在不同条件下,还可和有关反应物发生下列反应:F+B→C,G+A→E;③I是一种离子化合物,它可以水解产生一种白色沉淀和气体E。该白色沉淀加热可分解为H和H2O。而E则是分子晶体,其分子中共有10个电子。回答下列问题:
(1)在实验室中收集气体E的方法是__________________________________________。
(2)写出I和水反应的化学方程式____________________________________________。
(3)B的化学式是____________________________________________________。
(4)在实验室中,如果要获得干燥纯净的气体A,实验装置设计如图所示:
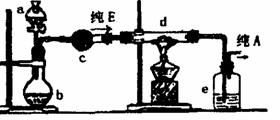
在上列装置b中原装的是一种固体物质,当s中的溶液滴入b内反应一段时间后,所得产物经装置c即为纯净气体E;在装置d中原装的是氧化铜,当E通入d时,氧化铜逐渐变为铜,最后从装置e中出来的气体是纯净的A气体。
①a中溶液和b中固体反应的化学方程式是_____________________________________。
②c装置盛放的试剂是______________________________________________________。
③纯净E通过d时反应的化学方程式是________________________________________。
④装置e盛放的试剂是______________________________________________________。
⑤收集干燥气体A的方法是(选a、b或c)____________________________。
a.用排气法收集在集气瓶中; b.用排水法收集在集气瓶中; c.直接收集在球胆或塑料袋中
47、将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:
I2(g)+H2(g)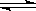 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示,
2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示,
⑴达平衡时,I2(g)的物质的量浓度为 。
⑵若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)
的变化如图曲线(III)所示。则甲条件可能是 (填入下列条件的序号。下同),乙
条件可能是 ____________。
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当催化剂
⑶若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、
b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是 。
46、M为一种常见的液体试剂。下列物质在一定条件下可发生如下图所示的转化关系。
试填写题中空白:
⑴ 若固体乙是硫化铝,试回答:
①C、E、F化学式C 、E 、F 。
②E→F的化学方程式 。
③D溶解于A溶液的离子方程式 。
⑵若白色沉淀D不能溶解于A溶液,气体C能使湿润的试纸变蓝,回答:
④固体乙可能 。
⑤B+C→M+E的化学方程式 。
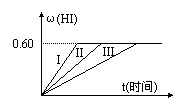
45、某链烃在一定条件下可和H2发生反应,取不同体积比的CnHm与H2(两者的体积和为定值V)在一定条件下反应,V与Φ(CnHm)、[CnHm的体积分数]的关系如图。则m和n的关系是:C
A.m=2n+2 B.m=2n
C.m=2n-2 D.m=2n-6
第II卷(非选择题)
44、在医院中,为酸中毒病人输液不应采用:B
A.0.9%氯化钠溶液 B.0.9%氯化铵溶液
 C.1.25%碳酸氢钠溶液 D.5%葡萄糖溶液
C.1.25%碳酸氢钠溶液 D.5%葡萄糖溶液
43、草酸(H2C2O4)溶液与酸性KMnO4溶液反应,在两溶液混和时看不到明显现象,但过一段时间后,混和溶液突然迅速褪色,此反应的化学方程式为:C
2KMnO4 + 3H2SO4 + 5H2C2O4 === K2SO4 + 2MnSO4 + 10CO2 + 8H2O,
据你的分析,突然褪色的原因可能是:
A.溶液已混和均匀了 B.反应中溶液酸性减弱
C.生成微量的Mn2+起催化作用 D.增大了外界的压强
42、60毫升由CO2和NO组成的混和气体,通入足量的Na2O2,余气通入足量水,此时无气体剩余,则原混和气体中CO2和NO的体积分别是:D
A.各30毫升 B.CO2 :40毫升,NO :20毫升
C.CO2 :24毫升,NO 36毫升 D.CO2 :36毫升,NO :24毫升
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com