
题目列表(包括答案和解析)
(五)无机化合物的分类
1. 按组成、性质分类
 金属氢化物
金属氢化物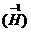 如NaH
如NaH
|
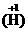 如HCl
如HCl
 组成 金属氧化物
组成 金属氧化物

 非金属氧化物
非金属氧化物
|
 碱性
碱性
 性质 成盐氧化物 酸性
性质 成盐氧化物 酸性
两性
 不成盐氧化物 如NO, CO, NO2
不成盐氧化物 如NO, CO, NO2
特殊氧化物 如Na2O2, KO2, Fe3O4
 是否含氧 含氧酸
如 HClO4
是否含氧 含氧酸
如 HClO4

 无氧酸 如HCl
无氧酸 如HCl
 电离出H+量 一元酸
如HNO3,HI
电离出H+量 一元酸
如HNO3,HI
 多元酸 如H3PO4, H2C2O4
多元酸 如H3PO4, H2C2O4
 酸根性质 氧化性酸
如浓H2SO4, HNO3, HMnO4
酸根性质 氧化性酸
如浓H2SO4, HNO3, HMnO4
 还原性酸
如HI, H2S
还原性酸
如HI, H2S
|
 电离程度 强酸
如HCl, H2SO4
电离程度 强酸
如HCl, H2SO4
 弱酸 如H2S. CH3COOH
弱酸 如H2S. CH3COOH
 挥发性 难挥发酸 如H3PO4,
H2SO4
挥发性 难挥发酸 如H3PO4,
H2SO4
 易挥发酸 如浓HCl, 浓HNO3
易挥发酸 如浓HCl, 浓HNO3
 稳定性 稳定性酸 如HCl, H2SO4,
H3PO4
稳定性 稳定性酸 如HCl, H2SO4,
H3PO4
 不稳定性酸 如HNO3, HI, H2S, H2SO3
不稳定性酸 如HNO3, HI, H2S, H2SO3
 电离出OH-数 一元碱 NaOH, NH3·H2O
电离出OH-数 一元碱 NaOH, NH3·H2O
 多元碱Ba(OH)2, Mg(OH)2
多元碱Ba(OH)2, Mg(OH)2
|
 溶解性 可溶性碱 如NaOH, NH3·H2O
溶解性 可溶性碱 如NaOH, NH3·H2O
 难溶性碱 如Mg(OH)2, Fe(OH)3
难溶性碱 如Mg(OH)2, Fe(OH)3
 电离程度 强碱
如 KOH
电离程度 强碱
如 KOH
 弱碱
如NH3·H2O
弱碱
如NH3·H2O
 正 盐 如 K2SO4
正 盐 如 K2SO4
|
碱式盐 如 Cu2(OH)2CO3
复 盐 如 KAl(SO4)2·12H2O
络 盐 如 Na3AlF6
想一想:复盐和络盐有何区别?(提示:根据能否电离出络合离子。)
2. 按微粒间成键种类分
 共价化合物: 如 CO2, SiO2
共价化合物: 如 CO2, SiO2
化合物
离子化合物 如 NaCl, NH4Cl
3.按能否电离来分
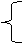 电解质 电离 强电解质
电解质 电离 强电解质
 化合物
程度 弱电解质
化合物
程度 弱电解质
非电解质
(四)比较“四同”
|
名称 内容 |
同位素 |
同素异形体 |
同系物 |
同分异构体 |
|
相同点 |
质子数 |
元素 |
结构相似官能团种类和个数 |
化学式 |
|
不同点 |
中子数 |
分子构成或晶体结构 |
分子组成相差(CH2)n |
分子结构 |
|
对象 |
原子 |
单质 |
有机物 |
有机物 |
|
物性 |
不同 |
不同 |
不同 |
不同 |
|
化性 |
几乎相同 |
相似 |
相似 |
相似或不同 |
|
实例 |
 D. T D. T |
O2、O3;红磷,白磷;金刚石,石墨 |
乙烯,丙烯;甲苯,乙苯 |
乙醇,甲醚;甘氨酸,硝基乙烷 |

(三)判别混合物和纯净物
首先抓住基本特征,列表比较如下:
|
纯净物 |
混合物 |
|
①有固定的组成和结构 ②有一定的熔、沸点 ③保持一种物质的性质 |
无固定组成和结构 无一定的熔、沸点 保持原有物质各自的化学性质 |
其次,要熟悉一些常见的混合物的名称、组分等
最后,对一些物质混合在一起,要注意有无反应的可能性(是否具备反应条件)、反应的完全性(反应若为可逆,一定得到的是混合物)、反应物间得投料比等诸多情况。
(二)物质的构成微粒
如何判断一种物质是由何种微粒构成?
先看一个实例 :
下列均由分子构成的一组物质是( )
A. CH4, H2O, SiO2 B. CS2, O2, Cl2
C. P, C, SiH4 D. C2H4, H3PO4, NaCl
要解答此类问题,首先必须弄清每种化学式所指物质的晶体类型,以及每种微粒能构成物质的常见类别,现列表如下:
|
晶体类型 |
构成微粒 |
常见物质类别 |
实 例 |
|
原子晶体 |
原子 |
少数非金属单质、某些非金属氧化物 |
金刚石 Si, SiO2 |
|
分子晶体 |
分子 |
某些非金属单质、气态氢化物和氧化物、酸、有机物 |
H2, O2, HCl, H2O, SO2, SO3, C2H4, C2H5OH |
|
离子晶体 |
阴、阳离子 |
大多数盐(含铵盐)、强碱、大多数金属氧化物、金属氢化物 |
NaCl,NH4NO3 、NaOH, MgO、Na2O2、NaH等 |
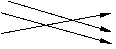
由表可进一步找出下列关系
微粒 形成的物质种类
 离子
单
质
离子
单
质
原子
 分子
化合物
分子
化合物
如掌握以上知识,再看例题,则不难选出正确答案为B
(一)元素和微粒的区别
 元素--宏观概念, 只论种类不论个数
元素--宏观概念, 只论种类不论个数
1.概念的范畴不同
微粒--微观概念, 既论种类又论个数
 元素--由核电荷数(即质子数)决定
元素--由核电荷数(即质子数)决定
2.决定种类的因素不同 原子--由质子数和中子数两者来决定
分子--由原子的种类、个数及结合方式(考虑同分异构体)决定
离子--由它的组成、结构及电荷数决定
例如:氢元素只有一种,氢原子有三种:氕(H) 氘(D)、氚(T).
H、、D、T相互形成的氢分子有六种。
想一想:若由两种氢原子(H、D)和两种氧原子(16O、18O)形成的水分子、过氧化氢分子各有几种?
提示:① 分析水分子时,固定一种氧原子,两种氢组合可有三种,再换一种氧原子,又有三种,共六种。
②分析过氧化氢分子时,两种氧组合可有三种,两种氢组合可有三种,这样就有九种,但不要忽视:H-16O-18O-D和D -16O-18O- H是两种不同的分子。注意分子不是左右对称。
27.为了测定某烷烃样品(丁烷,并含少量丙烷等气态烃)的平均相对分子质量,设计了下面的实验:
①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得质量m1(质量单位:g下同);
②往锥形瓶内通入干燥的该烷烃样品,塞好胶塞,准确称量;重复操作,直到前后两次称量结果基本相同,得到质量m2;
③往锥形瓶内加满水,塞好胶塞,称量得到质量m3.
已知实验时的温度压强不变(未测定具体数值),水的密度为ρ(水)g·L-1,空气的平均相对分子质量为29.0,空气的密度为ρ(空气)g·L-1,
回答下列问题:
(1)本实验的原理是(用文字具体说明)________________________________
____________________________________________________________________
(2)步骤②中为什么要复操作,直到前后两次称量结果基本相同?
____________________________________________________________________
(3)第一次称量前,锥形瓶塞紧胶塞后,在瓶口处的胶塞上做一记号,以后每次测量时胶塞塞入瓶口的位置都以为准,目的是:
______________________________________________________________________.
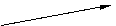
(4)本实验中收集样品的操作,可选用的方法是(填图中标号)___________.
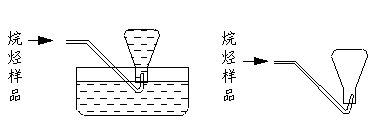
A B

C D
(5)锥形瓶内空气的质量[m(空气)]用m1、m3、ρ(空气)、ρ(水)表示为_________.
(6)瓶中样品质量用m1、m2、m(空气)表示为_____________.
(7)由实验测得该烷烃的平均相对分子质量用m1、m2、m(空气)表示为_________.
26.从某些方面看,氨和水相当,NH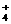 和H2O+(常写成H+)相当,NH
和H2O+(常写成H+)相当,NH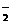 和OH-相当,NH2-(有时还包括N3-)和O2-相当,已知在液氨中酸发生下列两个反应:
和OH-相当,NH2-(有时还包括N3-)和O2-相当,已知在液氨中酸发生下列两个反应:
(1)NH4Cl+KNH2=KCl+2NH3
(2)2NH4I+PbNH=PbI2+3NH3
请写出能在水溶液中发生与上述两个反应相当的反应方程式(1)_________________(2)___________________.
25.化合物E(含两种元素)与NH3反应,生成化合物G和H2,化合物G的式量约为81;G分子中硼元素(B原子量为10.8)和氢元素的质量分数分别是40%和7.4%由此推断:
(1)化合物G的分子式为____________
(2)反应消耗1molNH3,可生成2molH2,组成化合物E的元素是_______和______
(3)1molE和2molNH3恰好完全反应,化合物E的分子式为________
24.金属X和非金属Y可直接化合生成化合物XY,甲、乙、丙三人分别做X和Y的化合实验,充分反应时每人所用X和Y的质量各不相同,但总质量均为10g.有关实验数据如下表:
|
|
X用量 |
Y用量 |
得XY量 |
|
甲 |
8g |
2g |
8g |
|
乙 |
6g |
4g |
8g |
(1)利用表中数据判断X和Y反应时,X和Y的质量比为___________
(2)若丙同学在实验中得到6gXY,则丙同学X和Y的用量分别是_________、________
23.将4mLO2和3mlNxHy(y>x)混合气体在150℃和1.05×105Pa下点燃,完全反应后,恢复到原来的温度与压强时,测得反应后N2、O2、H2O(g)混合气体比原混合气体的密度减少3/10.
(1)此反应的化学方程式是(用NxHy表示)__________________________
(2)推算NxHy化学式的根据是_________________
(3)x与y的关系式为__________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com