
题目列表(包括答案和解析)
4. 向含3mol Ca(OH)2的石灰水中逐滴加入H3PO4溶液至不再发生反应为止,所得盐的物质的量(纵坐标y)与加入H3PO4物质的量(横坐标x)的关系图是
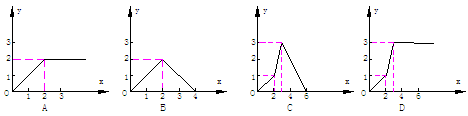
3.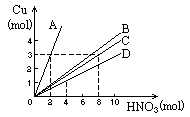 如图表示Cu与稀HNO3反应的量的关系,问哪一条线表示Cu与稀HNO3反应中被还原的硝酸与Cu的量的关系:[ ]
如图表示Cu与稀HNO3反应的量的关系,问哪一条线表示Cu与稀HNO3反应中被还原的硝酸与Cu的量的关系:[ ]
2. 将物质的量相等的硫酸铝和硫酸铵溶水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是[ ]
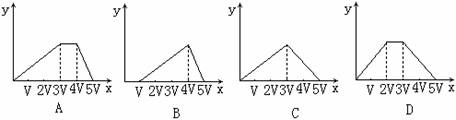
1.将0.03molCl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程中,溶液的[H+]与Cl2用量的关系示意图是(溶液的体积示为不变)[ ]

6. 实验室用右图装置制取溴化亚铁,其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是耐高温的瓷皿,其中装有56 g细铁粉。实验开始时,先将铁粉加热至600 ℃~700 ℃,然后将干燥、纯净的CO2气体通过D中,E管中反应开始,最后将d中液溴滴入100 ℃~120 ℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80 g。请回答:
实验室用右图装置制取溴化亚铁,其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是耐高温的瓷皿,其中装有56 g细铁粉。实验开始时,先将铁粉加热至600 ℃~700 ℃,然后将干燥、纯净的CO2气体通过D中,E管中反应开始,最后将d中液溴滴入100 ℃~120 ℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80 g。请回答:
⑴如何检查用塞子(插有导管和仪器)塞紧D的装置的气密性?
⑵若导入的CO2不干燥,会在E中发生副反应,其化学方程式为 。若在A中盛有固体CaCO3,a中盛有6 mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂是:B为 ,C为
。
⑶实验时,装置D和E橡皮塞最好用锡箔包住,原因是 。
⑷反应过程中要不断通入CO2,其主要作用是:① ;② 。
⑸E中反应为:2Fe+3Br2=2FeBr3 2FeBr3 2FeBr2+Br2↑,求此实验中溴化亚铁的产率:
。
2FeBr2+Br2↑,求此实验中溴化亚铁的产率:
。
⑹为防止污染空气,实验时应F处连接盛 的尾气吸收装置。
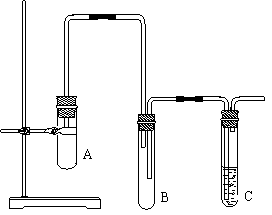
5.已知1,2-二氯乙烷常温下为无色液体,沸点83.5 ℃,密度1.23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂。乙醇的沸点为78.5 ℃。某化学课外活动小组为研究1,2-二氯乙烷的消去反应,设计了如下实验装置。
请回答下列问题:
⑴为了检验整套装置的气密性,某同学将导气管末端插入盛水的烧杯中,用双手捂着装置A中大试管,但几乎不能说明装置是否密闭。请回答如何检查装置气密性
。
⑵向装置A中大试管里先加入1,2-二氯乙烷和NaOH的乙醇溶液,再加入 ,目的是 ,并向装置C中试管里加入适量稀溴水。
⑶为了使反应在75 ℃左右进行,常用的方法是 。
⑷与装置A中大试管相连接的长玻璃管的作用是 ,装置B的作用是 。
⑸证明1,2-二氯乙烷以发生消去反应的现象是 ,装置A、C中发生反应的化学方程式为:装置A ,装置C 。
4.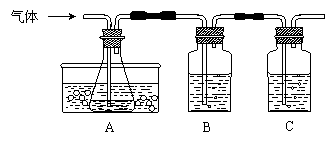 已知FeSO4在高温下分解生成Fe2O3、SO3和SO2。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
已知FeSO4在高温下分解生成Fe2O3、SO3和SO2。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
请回答下列问题:
⑴实验时,A瓶内盛水,水中滴有数滴 溶液,B瓶内盛品红试液,C瓶内盛NaOH溶液,NaOH溶液的作用是 。
⑵A瓶内所盛试剂的作用是 ,A瓶要用冰水冷却的原因是 。
⑶检验后,用A瓶内的混合物测定FeSO4已分解的质量,其实验操作的第一步是(简述操作步骤) 。
⑷测定过程中,在过滤器上将沉淀洗净后,将沉淀灼烧并冷却至室温,称量其质量为a1 g,再次灼烧并冷却至室温,称量其质量为a2 g,且a2< a1,接下来的操作应当是
。
 ⑸已经分解的FeSO4的质量是 (填计算式)。
⑸已经分解的FeSO4的质量是 (填计算式)。
3.白磷的着火点40 ℃,在室温或夏天正常取出时,就可观察到其被氧化而冒“白烟”,请简单说明你如何将大块的白磷改变成小块的白磷。
2.将CaCl2溶液滴入NaHCO3溶液中,一段时间后出现沉淀,有同学认为是生成了Ca(HCO3)2沉淀,有同学认为是CaCO3沉淀,试设计一个最简单的实验来证明沉淀的成分是什么。要求写出实验操作步骤、现象、结论。
1.在化学实验室里点燃可燃性气体,为了确保安全,往往在气体发生器的导管口加上一个放回火装置,防止因气体不纯,发生火焰回缩,使气体发生器里的气体引燃发生爆炸。说明右图的两种放回火装置能防爆的原因。
甲: 。
乙: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com