
题目列表(包括答案和解析)
21.(8分)已知某溶液中只存在OH一、H+、NH4+、Cl一四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①(Cl一)>c(NH4+)> c(H+)> c(OH-) ②c(Cl一) >c(NH4+)> c(OH-)> c(H+)
③c(NH4+)>c(Cl一)> c(OH-)> c(H+) ④ c(Cl一) >c(H+)> c(NH4+)> c(OH-)
填写下列空白:
(1)由若溶液中只溶解了一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序为_______________(填序号)
(2)若上述关系中③是正确的,则溶液中的溶质为____________________;
若上述关系中④是正确的,则溶液中的溶质为________________________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“大于”、“小于”或“等于”、下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____________ c(OH-)。
20.(13分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”中制取NaHCO3实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末.有NH4Cl晶体析出。……
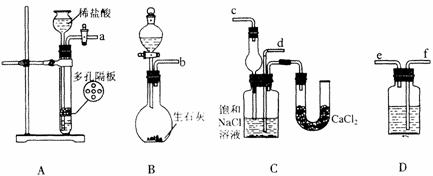
请回答下列问题:
(l)装置的连接顺序是:(a)接( ) ( )接( );(b)接( )
(2)A中常选用的固体反应物为___________;D中应选用的液体为_________;B中发生反应的化学方程式为________________________________________________。
(3)第二步骤中必须先让________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是____________,C中广口瓶内产生固体 的总化学方程式为_________________________________________________。
(5)第四步中分离出 NH4Cl晶体的操作是___________;其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象:______________________
________________________________________________________________ 。
19. (7分)(1)无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝结成
像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸。答:
(2)要配制浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是
(填代号)。
A. 称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B. 称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C. 称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D. 用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
18. 将一定量的Fe、Fe2O3、CuO的混合物放入体积为l00mL、浓度为2.2mol·L-1的H2SO4溶液中,充分反应后,生成气体 896mL(标况),得到不溶固体1.28 g,过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为 100mL)。向滤液满加 2mol·L-1的 NaOH溶液至40mL时开始出现沉淀。则未滴加 NaOH溶液前滤液中 FeSO4的物质的量浓度为 ( )
A.2 mol·L-1 B. l.8 mol·L-1 C.1.9 mol·L-1 D. 无法计算
第Ⅱ卷 非选择题 (满分78分)
17.体积相同,浓度均为 0. l mol·L-1的NaOH溶液、氨水,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为 ( )
A. 4m=n B.m=n C.m<n D.m>n
16. 2003年中国载人航天飞船“神舟” 号是用 N2H4(联氨)与N2O4作推力能源,其未配平的反应式为N2O4+ N2H4→N2+H2O,下列说法正确的是 ( )
A. N2既是氧化产物又是还原产物
B. 氧化产物与还原产物物质的量之比为1:2
C. 联氨是氧化剂
D.氧化剂与还原剂物质的量之比为2:1
15. 下列用来表示物质变化的化学用语中,正确的是 ( )
A. 钢铁腐蚀时可能发生的正极反应:2H2O+ O2+ 4e-=4OH一
B. 明矾水解的离子方程式: Al3++3
H2O Al(OH)3+3H+
Al(OH)3+3H+
C.氢氧化钙溶液与碳酸氢钠溶液混合:OH-+ HCO3一=H2O+ CO32-
D.可表示氢气燃烧的热化学方程式2H2(g)+O2(g)=2H2O(l);△H=+571.6kJ·mol-1
14. 砒霜的主要成分是As2O3,剧毒,致死量为0.1g。As2O3是两性偏酸性氧化物,微溶于水,生成H3AsO4;该酸及其对应的盐也均有毒性,其中碱金属对应的盐溶于水,其他金属对应的盐均几乎不溶于水。下列关于处理一瓶含有砒霜废液的方案中正确的是( )
A. 直接倒入下水道 B.经过滤后倒入下水道
C. 加入足量生石灰后,倒入指定地点 D. 加入足量氢氧化钠后,倒入指定地点
13. 在含有I一且能使酚酞变红的无色溶液中,可大量存在的离子组是 ( )
A. Na+、Cu2+、Br一、Cl- B.AlO2-、K+、NH4+、Na+
C.K+、Na+、NO3-、H+ D. K+、S2-、SO42-、OH-
12. 脑白金,其有效成分的结构简式为右式,下列对该化合物
脑白金,其有效成分的结构简式为右式,下列对该化合物
的叙述正确的是 ( )
A. 它属于芳香烃 B.它属于高分子化合物
C.分子式为C13N2H16O2 D. 在一定条件下可以发生加成反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com