
题目列表(包括答案和解析)
5.将某溶液逐滴加入Fe(OH)3溶胶中,开始时产生沉淀,继续滴加沉淀又溶解,该溶液是
( )
A. 2 mol·L-1 HCl溶液 B. 2 mol·L-1 NaOH溶液
C. 2 mol·L-1 MgSO4溶液 D.硅酸溶液
4. 下列离子化合物中阳离子半径和阴离子半径之比最大的是 ( )
A. LiI B.NaBr C. KCl D. CsF
3.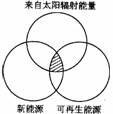 “能源分类相关图”如下图所示,下列四组选项中,全部符合图中阴影部分的能源是( )
“能源分类相关图”如下图所示,下列四组选项中,全部符合图中阴影部分的能源是( )
A. 煤炭、石油、沼气
B.水能、生物能、天然气
C.太阳能、风能、潮汐能
D.地热能、海洋能、核能
2. 水资源非常重要,联合国确定2003年为国际淡水年。下列关于水的说法中错误的是( )
A. 蒸馏法是海水淡化的方法之一
B. 淡水的密度小于海水的密度
C. 融化的雪水中矿物质含量比深井水中的少
D. 0℃以上,温度越高,水的密度越小
1.下列做法不利于改善环境的是 ( )
A. 焚烧农作物秸秆 B.提倡使用农家肥
C.用H2作还原剂冶炼金属 D.限制燃油汽车数量的增加
26.(10分)已知;标准状况下。1体积水能溶解2.3体积氯气,其中约有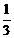 的氯气和水发生反应。20℃时,氯化钠的溶解度为36g,饱和溶液的密度为1.18g·cm-3,20℃时,饱和盐酸溶液的质量分数约为37%,溶液密度为1.19g·cm-3。
的氯气和水发生反应。20℃时,氯化钠的溶解度为36g,饱和溶液的密度为1.18g·cm-3,20℃时,饱和盐酸溶液的质量分数约为37%,溶液密度为1.19g·cm-3。
(1)计算20℃时饱和氯化钠溶液和盐酸溶液的物质的量浓度。
(2)通过计算说明20℃时,当氯气中混有少量氯化氢气体时,可以用饱和食盐水除去。
25. (9分)为了预防碘缺乏病,国家规定每千克食盐中应含有40-50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:
IO3-+5I-+6 H+→3I2+3H2O
I2+2S2O32-→2I-+S4O62-
24.(9分)煤的气化和液化是使煤
变成清洁能源的有效途径。
煤气化的主要反应是:
|
C+H2O(g)=== CO+H2,
CO和 H2的混合气体是合
成多种有机物的原料气。右图是合成某些物质的路线。其中,D易溶于水,且与 CH3COOH
互为同分异构体;F分子中的碳原子数是 D的 3倍;H经催化氧化可得到G。请回答
下列问题:
①写出下列物质的结构简式:
A__________________、H_____________________;指出A和H的关系_________。
②写出下列反应;
D与新制Cu(OH)2共热 _____________________________
③E→F ___________________________________________________________。
23. (10分) 自20世纪90年代以
(10分) 自20世纪90年代以
来,芳炔类大环化合物的研
究发展十分迅速,具有不同
分子结构和几何形状的这
一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙
炔(CH≡C- )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构如
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构如
上式:
(1)上述系列中第1种物质的分子式为 。
(2)已知上述系列第1至第4种物质的分子直径在1-100nm之间,分别将它们溶解于有机溶剂中,形成的分散系为 。
(3)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为 。
(4)在实验中,制备上述系列化合物的原料苯乙炔可用苯乙烯(CH2=CH- )为起始物质,通过加成、消去反应制得。写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
)为起始物质,通过加成、消去反应制得。写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)

22.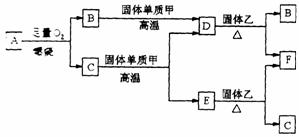 (12分)气体 A只含 X、Y两种短周期
(12分)气体 A只含 X、Y两种短周期
元素,X的原子序数大于 Y的原子序
数。 B、D、E是中学化学中的常见气
体。固体乙是一种复杂的化合物,是具
有磁性的黑色晶体;F是目前用途最广、
用量最大的金属单质,F与C在高温下发生反应生成Z和固体乙。各物质有如下图所示
的转化关系。
试回答下列问题:
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有(写化学式)__________。
(2)若气体A的分子为线型结构,且X与Y两元素的质量比数值上等于X的相对原子质量,则X元素位于周期表________周期,________族,A的电子式为_______________。
(3)写出下列反应的化学方程式(是离子反应的,写离子方程式):
在高温下,C与固体甲反应_________________________________________________,
在高温下,F与C反应 ____________________________________________________,
F与足量稀HNO3反应 ____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com