
题目列表(包括答案和解析)
19. (10分)某学生为测定氯化铵与硫酸铵混合物中氯化铵的质量分数,按下图所示实验步骤进
行实验:
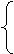 滤液B
滤液B
称量样品 → 溶解 → 滴加过量溶液A → 过滤
沉淀 → 洗涤 → 烘干 → 物质C
请回答下列问题:
(1)物质C的化学式是________;
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码16g,游码为0.4g,则右
盘样品的实际质量是____________;
(3)若过滤用的仪器和用品已有滤纸、铁架台、铁圈、烧杯、漏斗等,还需要的仪器
或用品是_____________________________;
(4)证明A溶液滴加过量的操作方法是
____________________________________________________________;
(5)若物质C的质量为23.3g,则原混合物中NH4Cl的质量分数为____________。
18.下列各组溶液混合后,溶液的PH一定大于7的是 ( )
A. 含等物质的量的HNO3、Na2CO3、CH3COOH溶液混合
B. pH= 2的盐酸和 pH=12的氨水等体积混合
C.pH= 3的某酸和 pH= 11的某碱等体积混合
D.pH=2的CH3COOH和pH=12的NaOH溶液等体积混合
第Ⅱ卷 非选择题 (满分78分)
17. “喷水溶液法” 是日本科学家最近研制出的一种使沙漠变绿洲的技术,它是先在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土粒子结合,在地表下30cm~50cm处形成一个厚0.50cm的隔水层,既能阻止地下的盐分上升,又有拦截、蓄积雨水作用,下列对聚丙烯酸酯的说法错误的是 ( )
A. 它的单体的结构简式为CH2=CHCOOR
B.它在一定条件下能发生加成反应
C.它在一定条件下能发生水解反应
D.它没有固定熔沸点
16.在一定温度下,硫酸铜晶体的培养皿中存在下列平衡: Cu2+ +SO42- +x H2O CuSO4·xH2O
,当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是 ( )
CuSO4·xH2O
,当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是 ( )
A.溶液中Cu2+浓度增大 B.溶液中Cu2+数目减少
C.该硫酸铜晶体体积增大 D.溶液的蓝色变浅
15.化学工作者把烷烃、烯烃、环烷烃、炔烃、……的通式转化成键数的通式,给研究有机物分子中键能大小的规律带来了很大方便。设键数为I则烷烃中碳原子数跟键数的关系的通式为CnI3n+1,烯烃(视双键为两条单键)、环烷烃中碳原子数跟键数关系的通式为CnI3n,则苯的同系物中碳原子数跟键数关系的通式为 ( )
A.CnI3n-1 B.CnI3n-2 C.CnI3n-3 D.C nI3n-4
14.沼气是一种能源,它的主要成分是 CH4,0.5 mol CH4完全燃烧生成 CO2和 H2O时,放出 445kJ热量,则下列热化学方程式中正确的是 ( )
A.2CH4(g)+4O2(g)→2CO2(g)+4H2O(1);△H=+890kJ·mol-1
B.CH4(g)+2O2(g)→CO2(g)+2H2O(1);△H=+445kJ·mol-1
C. CH4(g)+2O2(g)→CO2(g)+2H2O(1); △H=-890kJ·mol-1
D. 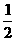 CH4(g)+O2(g)→
CH4(g)+O2(g)→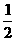 CO2(g)+H2O(1);△H=-445kJ·mol-1
CO2(g)+H2O(1);△H=-445kJ·mol-1
13.在一定体积和一定条件下有反应N2+3H2 2NH3,现分别从两条途径建立平衡:
2NH3,现分别从两条途径建立平衡:
I.起始浓度 N2 l mol·L-1, H2 3 mol·L-1
II. 起始浓度 N2 2 mol·L-1, H2 6 mol·L-1
下列叙述正确的是
A. I和II两途径达到平衡时,体系内各成分的体积分数相同
B.达到平衡时,I途径的反应速率v(H2)等于II途径的反应速率v(H2)
C.达到平衡时,I途径体系内混合气体的密度为途径II体系内混合气体的密度的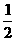
D.达到平衡时,II途径体系内混合气体的压强是I途径内混合气体压强的2倍
12. 物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成型的生物原电池,下列有关判断正确的是 ( )
A.正极的电极反应可能是 O2+ 4e-+ 2H2O→4OH-
B.负极的电极反应可能是 O2+ 4e-+ 2H2O→4OH-
C.负极的反应主要是C6H12O6(葡萄糖)生成CO2或HCO3-
D.正极的反应主要是C6H12O6(葡萄糖)生成CO2或HCO3-
11.下列离子方程式不正确的是 ( )
A. 向NaHSO4溶液中加入Ba(OH)2溶液呈中性
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.向NaAlO2溶液中加入过量盐酸,至溶液呈酸性
AlO2+ H++H2O==Al(OH)3 ↓
C.在碳酸氢铵溶液中加入过量的NaOH溶液
NH4++HCO3- + 2OH-==NH3↑+CO32-+2H2O
D. 往苯酚钠溶液中通入足量的CO2
2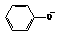 +CO2+H2O→2
+CO2+H2O→2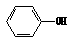 + CO32-
+ CO32-
10.下列叙述正确的是 ( )
A. 两种微粒,若核外电子排布完全相同,则化学性质一定相同
B.由单原子形成的离子,一定具有稀有气体元素原子核外电子排布
C.两原子,如果核外电子排布相同,则一定属于同一种元素
D. 阴离子的核外电子排布一定与上一周期稀有气体原子核外排布相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com