
题目列表(包括答案和解析)
27.(10分)某化工厂每小时生产98%(质量分数)硫酸at(吨),为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则
(1)该厂每小时消耗标准状况下空气的体积为 m3。
(2)为满足题设需求,b%的下限等于 。
26.(9分)在10℃时,向100g25.2%的稀硝酸中先后加入固体NaHCO3和NaOH共20.4g,恰好完全反应,把所得溶液蒸发掉39.5g水后,刚好成为饱和溶液(10℃),求此溶液中溶质的质量和该溶质在10℃时的溶解度。
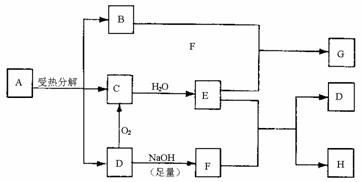 24.(8分)已知:A是硫酸盐,且A和G、C和D、F和H元素组成相同。G和KSCN溶液混合后溶液显血红色。反应过程产生的水在图示中已略去。
24.(8分)已知:A是硫酸盐,且A和G、C和D、F和H元素组成相同。G和KSCN溶液混合后溶液显血红色。反应过程产生的水在图示中已略去。
回答下列问题:
(1)写出G和H的化学式:G 、H 。
(2)工业生产中D转化为C的反应条件是: 。
(3)B跟E反应的离子方程式是 。
25.(12分)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
(1)下列热化学方程中,能直接表示出氯化钠晶体格能的是 。
A.Na+(g)+Cl-(g) NaCl(s); △H B.Na(s)+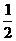 Cl2(g)
Cl2(g) NaCl(s); △H1
C.Na(s) Na(g); △H2 D.Na(g)-e- Na+(g);
△H3
E.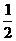 Cl2(g)
Cl2(g) Cl(g); △H4 F.Cl(g)+e- Cl-(g); △H5
(2)写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式 。
氧化亚铁晶体结构氯化钠晶体结构相似,则:
(3)氯化亚铁晶体中,跟二价铁离子紧邻且等距的氧离子个数是 。
(4)设阿伏加德罗常数值为NA,若氧化亚铁的密度为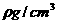 ,则氧化亚铁晶体中二价离子与氧离子之间最近距离是
cm(用代数式表示)
,则氧化亚铁晶体中二价离子与氧离子之间最近距离是
cm(用代数式表示)
(5)若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,该晶体中氧离子的数目将______ (填“减少”、“增多”或“保持不变”)。
23.(8分)一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式:XY2(l)+ 3O2(g)== XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积为 672mL,密度是2.56 g•L-1,则:
①反应前的O2的体积是(标况) ;
②化合物XY2的式量是 ;
③若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为 和 。
22.(6分)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu==2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-==Cu2+;还原反应为:2Fe3++2e-==2Fe3+。
⑴请据此将反应3NO2+H2O==2H++2NO3-+NO拆写为两个半反应式。
氧化反应___________________________________________;
还原反应___________________________________________。
⑵已知某一反应的半反应式CH4+10OH- -8e-==CO32-+7H2O,O2+2H2O+4e-==4OH-。则总方程式为___________________________________________________________。
21.(12分)工业上测定SO2、N2、O2混合气体中SO2含量的装置如下图。反应管中装有碘的淀粉溶液,SO2和I2发生反应为(N2、O2不与I2反应):SO2+I2+2H2O==H2SO4+2HI
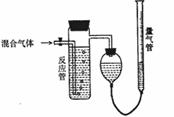 (1)混合气体进入反应管后,量气管内增加的水的体积
(1)混合气体进入反应管后,量气管内增加的水的体积
等于 的体积(填写混合气体的分子式)
(2)反应管内溶液蓝色消失后,没有及时停止通气,则
测得的SO2含量 (选填:偏高,偏低,不受影响)
(3)反应管内的碘的淀粉溶液也可以用 代替
(填物质的名称)
(4)若碘溶液体积为Va mL,浓度为Cmol/L。N2与O2的
体积为Vb mL(已折算成标准状况下的体积)。用C、Va、
Vb表示SO2的体积百分含量为 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为 。(填写下列仪器似的编号)
a烧杯 b试管 c广口瓶 d容量瓶 e量筒 f单孔塞 g双空塞
20.(9分)参看表格内容,回答下列问题:
|
物质 |
外观 |
在空气中加热时的现象 |
产物水溶液的酸碱性 |
|
X |
黑色粉未 |
燃烧时呈炽红色并发出火花,放出无色气体G |
微弱酸性 |
|
Y |
淡黄色晶体 |
首先熔化,然后燃烧,火焰为浅蓝色,放出有刺激性气味的气体 |
弱酸性 |
|
Z |
银白色固体 |
燃烧,产生黄色火焰,生成浅黄色固体F |
强碱性 |
⑴X、Y、Z、F分别是(写名称) 、 、 、 。
⑵G中的化学键 (填“有”或“没有”)极性。G在固态时属于 晶体
⑶Y和Z直接作用后的生成物属于 晶体。写出它的电子式 .
19.有m1 g KCl饱和溶液,其溶质的质量分数为c1%。改变温度或蒸发水后析出m3g KCl晶体,母液质量为m2g,其溶质的质量分为c2%。则下列关系一定正确的是 ( )
A.c1一定大于c2 B.m1-m3=m2
C.m1c1-m2c2=100m3 D.原条件下KCl的溶解度小于c1g
第II卷(非选择题,共74分)
18.工业制硫酸时,进入接触室的气体组成为:SO2占7%,O2占11%,N2占82%。据测定,一定体积的混和气体进入接触室后,体积变化为原来的97.2%,则SO2转化率是: ( )
A.50% B.60% C.75.3% D.80%
17.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是 ( )
A.稀盐酸,Na2CO3溶液 B.稀H2SO4溶液,NaAlO2溶液
C.Cu,FeCl3溶液 D.浓氨水,AgNO3溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com