
题目列表(包括答案和解析)
17.下列各组离子能在指定溶液中,大量共存的是 ( )
①无色溶液中:K+,Cl-,Na+,H2PO4-,PO43-,SO42-
②使PH=11的溶液中:CO32-,Na+,AlO2-,NO3-,S2-,SO32-
③水电离的H+浓度C(H+)=10-12mol·L-1的溶液中:Cl-,HCO3-,NO3-,NH4+,S2O3④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
⑤使甲基橙变红的溶液中:Fe3+,MnO4-,NO3-,Na+,SO42-
⑥酸性溶液中:Fe2+,Al3+,NO3-,I-,Cl-,S2-
A ①②⑤ B ①③⑥ C ②④⑤ D ①②④
16. 下列除去杂质的方法正确的是 ( )
|
|
物质 |
杂质 |
试剂 |
主要操作 |
|
A |
SiO2 |
Fe2O3 |
盐酸 |
过滤 |
|
B |
NaHCO3 |
Na2CO3 |
盐酸 |
加热 |
|
C |
Fe |
I2 |
/ |
加热 |
|
D |
Fe(NO3)2 |
Ba(NO3)2 |
硫酸 |
过滤 |
15.用下列方法测定空气中污染物的含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体的电阻越大,它的电导越小)。如测定H2S的含量,若用CuSO4溶液吸收,可测定很大浓度范围的H2S含量,但电导变化不大;若用浓溴水吸收,仅限于测定低浓度范围内H2S的含量,但有很高的灵敏度。现要兼顾吸收容量与灵敏度的情况下测定空气中氯气的含量,则应选用下列吸收剂中的 ( )
A.Na2SO3溶液 B.HI溶液 C.NaOH溶液 D.H2O溶液
14.下列离子方程式书写正确的是 ( )
A.将Ba(OH)2溶液不断加入KAl(SO4)2溶液中反应至沉淀物质的量最大:3Ba2++6OH-+2Al3++3 SO42-=3BaSO4↓+2Al(OH)3↓
B.Cl2通入冷水中:Cl2+H2O=Cl-+ClO-+2H+
C.CuSO4溶液跟Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓
D.漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
13.将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中以下各离子浓度关系正确的是 ( )
A.C(NO3 -)>C(OH-)>C(NH4+)>C(Ba2+) B.C(NO3-)>C(Ba2+ )>C(OH-)>C(NH4+)
C.[Ba2+]+[ NH4+]+[H+]=[NO3- ]+[OH-] D.2[Ba2+]+[ NH4+]+[H+]=[NO3 -]+[OH-]
12.某温度下,在一容积可变的容器中,反应2A(g)+B(g)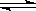 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
( )
A 均减半 B 均加倍 C 均增加1mol D 均减少1mol
11.已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族。下列推断不正确的是 ( )
A.A、B、E一定在不同周期 B.C的最高价氧化物的水化物可能显碱性
C.A、D可能在同一主族 D.C和D的单质可能化合形成离子化合物
10.在一恒温恒容的密闭容器内,放入3.0mol A、4.0mol B,发生如下反应:
3A(g)+4B(g)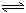 2C(g)+nD(g)[n可能为3、4、5、6、7、],若平衡时总压比起始时增大20%,则n可能是
( )
2C(g)+nD(g)[n可能为3、4、5、6、7、],若平衡时总压比起始时增大20%,则n可能是
( )
A.3 B.4 C.6 D.7
9.设NA表示阿伏加德罗常数,下列说法中不正确的是 ( )
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,如还原产物为NO,则被还原的氮原子数小于NA
B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.常温常压下,NA个臭氧分子的体积大于22.4L
D.1.8gH2O分子中含有的电子总数为NA
1999年诺贝尔化学奖授予了具有埃及和美国双重国籍的科学家艾哈迈德.泽维尔,以表彰他使“运用激光技术观察化学反应时分子中原子的运动”成为可能。请根据题示信息完成7-8题:
6.泽维尔研究了氰化碘的分解反应2ICN=I2+(CN)2,他发现这个反应是在200飞秒内完成的(飞秒:时间单位,1飞秒=10-15秒)。已知(CN)2的性质和卤素相似,则下列有关ICN的叙述正确的是 ( )
A.ICN的晶体是离子晶体 B.ICN是共价化合物
C.ICN不能与NaOH溶液反应 D.ICN在常温下不可能是固体
7.泽维尔还用激光技术研究了碘化钠的分解:2NaI=2Na+I2,他发现当对碘化钠晶体施以能量脉冲,当Na和I两核距离10~15Å(1 Å =10-10m)呈离子键;两核靠近约2.8 Å时呈共价键。由此可见 ( )
A.NaI 的晶体是离子晶体和原子晶体的化合物
B.Na和I之间既有离子键又有共价键
C.离子键和共价键之间没有明确的界限
D.NaI的熔点比较低
8.有下列离子晶体空间结构示意图:●为阳离子,○为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为 ( )
A  B
B 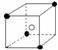 C
C 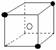 D
D 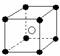
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com