
题目列表(包括答案和解析)
11,水解反应是广泛存在的一类反应,盐的水解即为一例,越弱越水解是盐水解的重要规律,如NaCl不水解、MgCl2水解,而同浓度的AlCl3水解程度比MgCl2高,从同周期中元素金属性递变规律看H4SiO4的碱性更弱,因而SiCl4水解更完全
Mg3N及CaC2与水反应也可看做水解,注意以下规律:
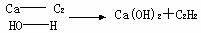
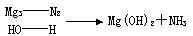
(1)写出下列化学方程式
①SiCl4水解:________________________________________________________________。
②PCl5水解:_________________________________________________________________。
(2)写出下列化学方程式:
①Ca3P2与水反应:____________________________________________________________;
②Mg3C2与水反应:___________________________________________________________。
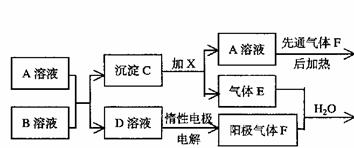 12,已知FeSO3不溶于水但可溶于强酸。下图表示一些常见无机物之间的转化关系:
12,已知FeSO3不溶于水但可溶于强酸。下图表示一些常见无机物之间的转化关系:
(1)请写出下列物质的化学式:C ,H: 。
(2)E与F等体积混合溶于水生成X+Y的离子方程式为 ,
电解D溶液的离子方程式为 。
7,已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1) 请写出并配平上述反应的化学方程式____________________________________。
(2) 此反应的还原剂是______________,它的氧化产物是_________________。
(3) 此反应的离子反应方程式可表示为:_______________________________。
(4) 若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
8,一个完整的氧化还原反应方程式可以拆写为两个“半反应”:一个是“氧化反应”式,一个是“还原反应”式,如:2Fe3++Cu==2Fe2++Cu2+的拆开结果是:氧化反应为:Cu-2e-==Cu2+ 还原反应为:2Fe3++2e-==2Fe2+
(1)请据此将反应:3NO2+H2O==2H++2NO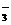 +NO拆写成两个“半反应式”
+NO拆写成两个“半反应式”
_____________________________________;_____________________________________。
(2)已知某一反应的半反应式为O2+2H2O+4e-==4OH-;CH4+10OH--8e-==CO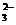 +7H2O,则总反应式为___________________________________________________________。
+7H2O,则总反应式为___________________________________________________________。
9,美国化学家路易斯提出的酸碱电子理论认为:凡能接受电子对的物质称为酸(如H+),能接受几对电子对则称几元酸,凡能给出电子对的物质称为碱(如NH3)。N2H4称为联氨,由NH3中的一个氢原子被一个NH2取代而成,它是一种重要的还原剂,常与NO2、F2一起作火箭燃料。
( l )N2H4是____元____(填“酸”或“碱”)。
( 2 )写出N2H4与 NO2、F2作火箭推动剂的反应方程式:
_____________________________________________________________;
_____________________________________________________________。
 10,铅蓄电池放电时起原电池的作用,充电时起电解池的作用,铅蓄电池在放电和充电时发生的化学反应可用下式表示:
10,铅蓄电池放电时起原电池的作用,充电时起电解池的作用,铅蓄电池在放电和充电时发生的化学反应可用下式表示:
(1)蓄电池使用日久后正负极标志模糊,现根据下列两种条件,如何来判断正负极:
①氯化铜溶液,两根带有铜导线的碳棒______________________________________。
②硫酸铜溶液,两根相同的铜导线__________________________________________。
(2)假如采用第②种方法进行实验,实验前后分别精确称重硫酸铜溶液和两根铜导线的总质量,假如不考虑实验误差,前者质量将_____(填“增大”、“减小”或“不变”);后者将______填(“增加”、“减少”或“不变”)。假使两根铜导线质量之差为0.32g,则铅蓄电池内部要消耗H2SO4_______mol。
(3)铅蓄电池的电压正常情况下保持2.0V,电压下降到约1.85V时需要重新充电,铅蓄电池充电时,阴极反应式为__________________________。
1,将放射性的同位素35S与非放射性的Na2SO3溶液一起加热煮沸可得Na2S2O3。若将所制得的Na2S2O3酸化,又可得到含放射性硫的沉淀,而逸出的气体SO2无放射性。有关反应的化学方程式为:S + Na2SO3 == Na2S2O3, S2O3 2- + 2 H+ == S + SO2 + H2O。 这一实验表明( )
(A) 两种硫之间没有发生交换作用
(B) 在Na2S2O3内部两个硫原子等价
(C) 在Na2S2O3内部两个硫原子不等价
(D) 在合成Na2S2O3时,放射性硫作还原剂
2,单质钛的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有:①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O,②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4,③H2TiO3=TiO2+H2O,④TiO2+2C+2Cl2= TiCl4↑+2CO↑,TiCl4+2Mg=2MgCl2+Ti,下列叙述错误的是( )
(A) 反应①是非氧化还原反应 (B) 反应②是水解反应
(C) 反应④中TiO2是氧化剂 (D) 反应⑤表现了金属镁还原性比金属钛强
3,在一定温度下,氢氧化镁饱和溶液中存在如下关系:c(Mg2+)·[c(OH-)]2=Ksp,其中Ksp称为Mg(OH)2的溶度积。试推断氢氧化镁在下列物质中的溶解度由小到大的顺序是( )
① 0.1mol/L MgCl2溶液 ② 0.lmol/L NH4Cl溶液
③ 0.1mol/L KCl溶液 ④ 0.1mol/L KOH溶液
(A)①④③② (B)②①③④ (C)③①④② (D)④①③②
4,现有铷和锌组成的合金共10g,与水作用有1.12L氢气(标准状况下)放出,则合金中锌的质量分数为(提示:锌同铝一样能溶于强碱)( )
(A) 57.25% (B) 42.75% (C) 28.63% (D) ABC都不正确
5,化学工作者把烷烃、烯烃、炔烃… …的通式转化成键数的通式,给研究有机物分子键能大小的规律带来了很大的方便。设键数为I,则烷烃中碳原子数与键数的关系的通式为CnI3n+1 ,烯烃、环烷烃中碳原子数与键数的关系的通式为CnI3n 。则苯的同系物中,碳原子数与键数关系的通式为( )
(A) CnI3n-1 (B) CnI3n-2 (C) CnI3n-3 (D) CnI3n-4
6,在加有稀H2SO4的H2O2溶液中,加入乙醚后,再加入少量K2Cr2O7溶液并振荡,在乙醚层中生成深蓝色的2CrO5•(C2H5)2O,其主要反应的离子方程式为:
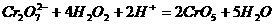
已知CrO5的结构为: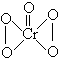
下列叙述正确的是( )
(A) 乙醚作萃取剂 (B) 此反应是氧化还原反应
(C) 可用乙醇代替乙醚 (D) 此反应中H2O2被氧化
24.现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后,全部投入含b molHNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)若剩余的残渣只有Cu,则溶液中含有的金属离子为_________。(写出所有可能情况)
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示)______________。
(3)当x=0.5时,溶液中Fe3+与Fe2+的物质的量相等时,在标准状况共产生672 mL气体。求a、b的值。
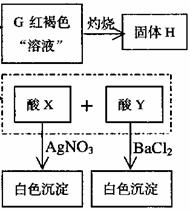
23.(15分)A是一种可溶于水的有机物。.从A出发,可发生图示的一系列反应而生成各种不同的有机化合物B、C、D、E、F、G、H。试写出:
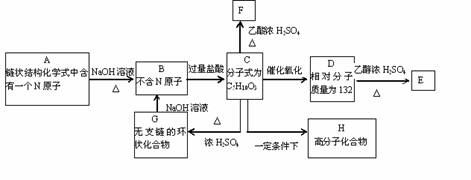
(1)化合物的结构简式:A____________ D___________ E___________。
(2)化学方程式
C→F__________________________________________。
C→H__________________________________________。
G→B___________________________________________。
22.(7分)由磷酸形成的磷脂及其化合物(如酶)是细胞的重要组成部分,它们对调节生命活动起了积极作用。假如缺少了磷,氮就是再多也不会被植物吸收。磷酸吡醛素(结构式为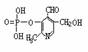 )能有效地促进植物对氮肥的吸收。 试回答:
)能有效地促进植物对氮肥的吸收。 试回答:
⑴磷酸吡醛素的分子式是 。此物质具有的性质是(填序号) 。
A.能与金属钠反应 B能发生银镜反应
C.能与FeCl3溶液反应 D能使石蕊试液变红
⑵写出磷酸吡醛素与足量氢氧化钠溶液反应的化式:
。
21.(16分)胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
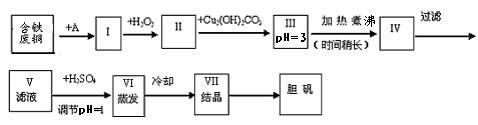 PH值控制可参考下列数据
PH值控制可参考下列数据
|
物
质 |
开始测定时的PH值 |
完全测定时的PH值 |
|
氢氧化铁 |
2.7 |
3.7 |
|
氢氧化亚铁 |
7.6 |
9.6 |
|
氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
(1) A物质可选用___________填字母。
(a)稀H2SO4 (b) 浓H2SO4 (c)浓FeCl3溶液 (d)浓HNO3
(2) I中加H2O2的目的___________________。
(3) II中加Cu2(OH)2CO3的目的是___________________________其优点是____________。
(4) III加热煮沸时发生的化学反应的离子方程式为__________________。
(5) V中加H2SO4调节PH=1是为了________________________________。
(6) 某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是__________________________________。若你是该工程师,将对所加的A物质作何改进?请提出建议_____________________________________。
20.(14分)(1)SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如下图所示,呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为________________________种。
(2).一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu==2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-==Cu2+;还原反应为:2Fe3++2e-==2Fe3+。
①请据此将反应3NO2+H2O==2H++2NO3-+NO拆写为两个半反应式。
氧化反应___________________________________________;
还原反应___________________________________________。
②已知某一反应的半反应式CH4+10OH- -8e-==CO32-+7H2O,O2+2H2O+4e-==4OH-。则总方程式为___________________________________________________________。
(3).一定量的液态化合物XY2,在一定量O2中恰好完全燃烧,反应方程式:XY2(l)+ 3O2(g)== XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积为 672mL,密度是2.56 g•L-1,则:
①反应前的O2的体积是(标况) ;
②化合物XY2的相对分子质量是 ;
③若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为 _、______。
19.(14分)为了测定某不溶于水的混合气体的平均相对分子质量(比空气重),设计了下列实验:①取一配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量m1。
②往锥形瓶中通入干燥的样品,塞好胶塞,准确称量;重复操作,直到前后两次称量结果基本相同,得到m2。
③往锥形瓶内加满水,塞好瓶塞,得到质量m3。
已知实验时温度为T(K),压强为P(kPa),水的密度为ρ水(g/L),空气的平均相对分子质量为29.0,空气密度为ρ空气(g/L),回答下列问题:
(1)本实验的理论依据是:
____________________________________________________________________。
(2)步骤②中重复操作至质量相同的原因___________________________。
(3)如何做到每次测量都是在相同体积下进行的?___________________
________________________________________________________________。
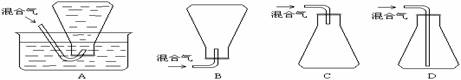 (4)本样品收集时,可选用的方法是____________。
(4)本样品收集时,可选用的方法是____________。
(5)锥形瓶内空气的质量(m空气)是______________________(列出计算式)。
(6)瓶中样品的质量(m样品)是______________________。
(7)该混合气的平均相对分子质量是:_____________________________(列出计算式)。
18.将0.2mol KMnO4在一定温度下加热后生成a molO2;将剩余固体与过量浓盐酸混合加热又生成b molCl2,此时锰元素全部以Mn2+形式存在。若a+b=m,则m的值可能为 ( )
A.0.35 B.0.45 C.0.55 D.0.60
第Ⅱ卷(非选择题共76分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com