
题目列表(包括答案和解析)
36.Cu+在酸性溶液中不稳定,可发生自身氧化-还原反应生成Cu和 Cu2+。现有浓H2SO4、浓HNO3、稀 H2SO4、稀 HNO3、FeCl3稀溶液及pH试纸,而没有其他试剂。简述如何用最简单的实验方法来检验CuO经过氢气还原所得到的红色产物中是否含有碱性氧化物Cu2O?
答:________________________。
35.甲、乙两位学生用两种不同方法制取氮气,并测定氮气的分子量(用密度法)。下面是甲、乙两位学生提出的两种制备氮气的实验方案(箭头表示气体的流向)。
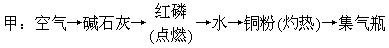
乙:NH4NO2→浓硫酸→镁粉(灼热)→集气瓶(NH4NO2  N2+2H2O)
N2+2H2O)
回答下列问题:
(1)甲、乙两位学生的实验方案是否能制氮气?甲______、乙______(填“能”或“不能”)。
(2)具体说明不能制取氮气的原因并纠正(若两种方案都能制氮气,此一小题不用回答)______。
(3)甲、乙方案中碱石灰和浓H2SO4可否交换位置?说明理由:______。
(4)甲、乙两位学生按正确装置制取的氮气,用密度法测出分子量(精确到0.0001),进行比较:M甲______M乙(填<或=或>)。
34.有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、 NO3-、SO42-、 Cl-、I-、HCO3-,取该溶液实验如下:
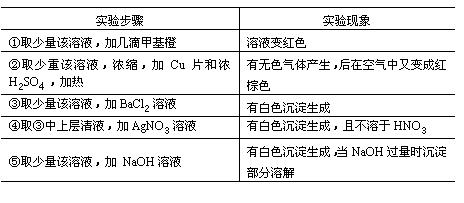
(1)溶液中肯定存在的离子是______。
(2)溶液中肯定不存在的离子是______。
(3)为进一步确定其他离子,应该补充的实验是______。
33.某学生为测定氯化铵与硫铵混合物中氯化铵的百分含量,按下图所示实验步骤进行实验:
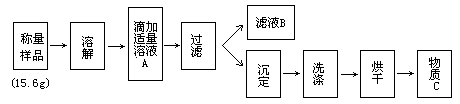
简答下列问题:
(1)溶液A溶质的分子式是______,物质C的分子式是______。
(2)若过滤用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗等,还需要的仪器或用品是______。
(3)证明A溶液滴加适量的操作方法是______。
(4)若物质C的质量为23.3g,则原混合物中NH4Cl的质量百分含量为_。
32.在实验室中常用浓盐酸和二氧化锰反应来制取氯气,装置如图4-46:

(1)写出A中反应的离子方程式:______
(2)指出B、C中物质的名称及作用
B中:______。
C中:______。
(3)D中收集到的气体是纯净的氯气吗?为什么?______。
(4)写出E中所发生反应的化学方程式,并画出实验装置图______。
(5)“加热时要缓缓加热,不要过急”。试解释这样做的原因:______。
31.有下列实验操作供选用:①加NaOH溶液;②加盐酸;③加硝酸;④加热;⑤加硝酸银溶液;⑥加水过滤;⑦加二氧化锰;⑧露置在空气中。
(1)证明一种金属粉末是铁粉,操作的顺序是______。
(2)证明氯酸钾中含有氯元素,操作的顺序是______。
(3)证明2-碘戊烷中含有碘元素,操作的顺序是______。
30.如4-45所示,在火棉胶袋(半透膜)内注入淀粉和食盐溶液,用线系紧密封,使细玻璃管内的液面刚好高出烧杯内蒸馏水的液面,过一段时间后用碘酒和硝酸银溶液分别检验“蒸馏水”。整个实验过程中观察到的现象是 [ ]
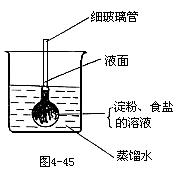
A.细玻璃管内液面下降
B.细玻璃管内液面不变
C.“蒸馏水”遇碘酒变蓝
D.“蒸馏水”遇硝酸银溶液有白色沉淀生成
29.下列实验操作中,仪器需插入液面下的有 [ ]
①制备Fe(OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中;②制备氢气的简易装置中的长颈漏斗;③分离石油时控制温度所用的温度计;④用乙醇制备乙烯时所用的温度计;⑤用水吸收氨气时的导气管;⑥向试管中的BaCl2溶液中滴加稀硫酸。
A.③⑤⑥
B.②⑤
C.①②④
D.①②③④⑤⑥
28.下列描述符合实验事实的是 [ ]
①用盐析的方法可以提纯蛋白质,②用渗析的方法可以除去淀粉中的Cl-,③用加饱和Na2CO3溶液的方法可以除去乙酸乙酯中的乙酸,④将乙烷和乙烯的混合气体与H2在催化剂作用下反应可除去乙烯。
A.①②③④
B.①②③
C.只有①②
D.只有③
27.要称取4.1g纯碱,①把托盘天平调整零点后;②在左盘放4g砝码,并把游码拨到0.1g处;③然后向右盘中较缓慢地放入纯碱粉末,至天平抬起且稍向砝码端下落时;④右手轻抖药匙使药品落下至天平平衡。以上操作最主要的错误有 [ ]
A.1处
B.2处
C.3处
D.4处
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com