
题目列表(包括答案和解析)
1、 钢铁发生吸氧腐蚀时,正极上发生的电极反应是 ( )
A、2H+ +2 e-= H2 B、Fe2+ +2e- =Fe
C、2H2 O+O2+4e- =4OH- D、Fe3++e- =Fe2+
31、请设计一实验证明CO32-、HCO3- 哪一个离子更容易结合H+ ?(写出实验步骤,现象及结论)
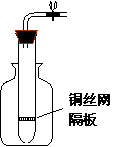
30、某学生用实验室常见的酸、碱、盐和金属为反应物,
并利用一个底部有小孔的试管和一个广口瓶组装成如图
所示的“替代简易气体发生器的装置”,该装置中装有
铜丝网隔板,利用该装置可制备哪些气体 ;
若将铜丝隔板改成铁丝网隔板,则该装置可用于制取何种
气体 ,写出反应方程式 。
29、据《中国环境报》报道:从一份科技攻关课题研究结果显示,我国酸雨区已占国土面积的40%。研究结果还表明,酸雨对我国浓作物、森林等影响区域很大。
如图是研究酸雨成因分析的学生实验用的“催化棒”。用两根外面套有玻璃管的粗导线穿过橡皮塞并固定粗玻璃管中,在其一端用电热丝连接起来,即制成“催化棒”。
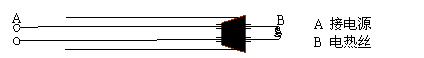
实验时,先接通直流电源,使电热丝红热,然后将红热的电热丝伸入装有SO2和空气的集气瓶中,瓶中立即出现 a 现象,在往其中加入盐酸酸化的BaCl2溶液,又出现 b 现象。请回答:
(1)现象:a ;b 。
(2)以上实验可得出酸雨成因的化学原理是 。
(3)目前一座中等城市每年用煤约300万吨,其含硫量如按1.0%计算,则每年排放SO2多少吨?若此二氧化硫有60%转化为H2SO4,相当于生成多少吨98%的H2SO4 ?
(4)接触法制硫酸工业中,尾气中SO2的处理方法很多。国际上最新采用“饱和亚硫酸钠溶液吸收法”进行回收,请写出有关反应的化学方程式 。
(5)取一份酸雨样品在空气中放置,每隔一段时间测定一次其pH,会发现其pH逐渐 ,
 其原因是
。
其原因是
。
28、已知Ag(NH3)2+ + 2H+ = Ag+ + 2NH4+ 。今有一白色固体,可能是由Al2(SO4)3 、AgNO3
BaCl2 、NH4Cl、 KOH、 Na2S中的2种或3种组成,为确定该白色固体的组成,进行以下实验;第一步:取白色固体少许,加入适量的蒸馏水充分振荡得无色溶液;第二步:取第一步实验所得的无色溶液少许,滴加适量的稀硝酸有白色沉淀产生。回答下列问题:
(1)此白色固体必须含有的物质及其相对含量第一组 ,第二组 。
(2)若要确定白色固体的组成,还需要做的实验是 ,可能发生反应的关离子方程式是 。
27、某无色溶液其中可能存在的离子如下:Na+ 、Ag+ 、Ba2+ 、Al3+ 、AlO2- 、S2- 、CO32-
SO32- 、SO42- ,现取该溶液进行有关实验,结果如下图所示








试回答下列问题
(1)沉淀甲是 ,生成沉淀甲的离子方程式是 。
(2)沉淀乙是 ,由溶液甲生成沉淀乙的离子方程式是 。
(3)沉淀丙是 ,如何用一实验来确定其成分? 。
(4)综合上述信息,可以肯定存在的离子有 ,可能存在的离子有 。
26、现在工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请回答下列问题:(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为 。
(2)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:a Na2CO3溶液 b Ba(OH)2溶液,c 稀盐酸,其合理的加入顺序为 (填试剂序号)。
(3)如果在容积为10L的离子交换膜电解槽中,1min在阴极可产生11.2L(标准状况)Cl2 ,这时溶液的pH是(设体积维持不变) 。
(4)Cl2常用于自来水的消毒杀菌,现在有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需Cl2和ClO2的物质的量之比为 。
25、已知C(S) + 1/2O2(g) = CO(g); ΔH = -110.5 kJ/mol
2CO(g) + O2(g) = 2CO2(g); ΔH = -566.0 kJ/mol 则C的燃烧热为 。
24、氯气在NaOH的碱性条件下可将Fe(NO3)3氧化为铁酸钠(Na2FeO4),写出这一反应的离子方程式(1) ,Na2FeO4能消毒杀菌的原因是 ,作为水处理过程中使用的一种新型净水剂的另一原因是(2) 。
23、高氯酸铵(NH4ClO4)在强热的条件下分解,生成N2、O2、HCl 和水,反应中生成的还原产物和氧化产物的物质的量之比是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com