
题目列表(包括答案和解析)
1.苹果汁是人们喜爱的饮料,由于其中含有亚铁离子,在榨取后不久往往会变为棕黄色,生产上常在其中加入维生素C以防止其变色,这是利用了维生素C的 ( )
A.氧化性 B.还原性 C.酸性 D.碱性
(二)非选择题
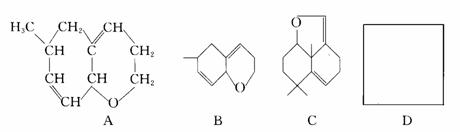
1.有机环状化合物的结构简式可进一步简化,例如A式可简写为B式。C式是1990年公开报道的第1000万种新化合物,该化合物C中的碳原子数是 ,分子式是 。若D是C的同分异构体,但D属酚类化合物,而且结构中没有-CH3基团。请写出D可能的结构简式(任意一种,填入D方框中)。
2.结构中没有环状的烷烃又名开链烷烃,其分子式通式是CnH2n+2(n是正整数)。 若它分子中每减少2个碳氢键,必然同时会增加1个碳碳键。该碳碳键可能是重键(双键或三键),也可能是连结成环状烃,都称为增加了1个不饱和度(用希腊字母Ω表示,又名“缺氢指数”)。例如若干烃类分子和烃基的不饱和度如下:
①CH3CH2CH3 Ω=0; ②(CH3)2CH- Ω=0;
③CH2 CHCH2 Ω=1;
CHCH2 Ω=1;
④ Ω=1; ⑤C8H15- Ω=1;
Ω=1; ⑤C8H15- Ω=1;
⑥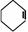 Ω=2; ⑦
Ω=2; ⑦  Ω=2;
Ω=2;
⑧CH3C≡CCH2C H=CH2 Ω=3;
⑨CH3(CH=CH)3CH3 Ω=3;
⑩? Ω=4;11? Ω=4;12C7H7-Ω=4。
(1)请写出下列各烃分子的Ω。
(A)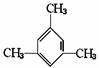 Ω=
Ω=
(B)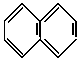 Ω=
Ω=
(C)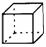 Ω=
Ω=
(2)请写出下列烃基的Ω。
(D) (两价基团)Ω=
(两价基团)Ω=
(E)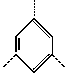 (三价基团)Ω=
(三价基团)Ω=
(F)?C≡C?(两价基团)Ω=
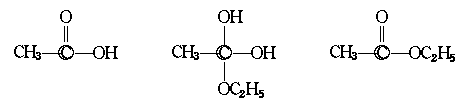
3.化学上拉席希法制备肼是将NaClO和NH3按物质的量1∶2混合,刚好反应生成NaCl、肼和水。肼是一种高能燃料。
(1)写出肼的化学式 ,推测其结构简式 。
(2)推测肼能否像氨一样和水形成水合物,如能形成水合物,写出反应的化学方程式。如不能形成水合物,说明理由: 。
4.4 mL O2和3 mL NxHy(已知x<y)混合气体在120℃、1.01×106Pa点燃完全反应后恢复到原温度和压强时,测得反应后N2、O2、H2O(g)混合气体密度减小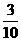 。试回答:
。试回答:
(1)写出反应的化学方程式: 。
(2)推算出NxHy的化学式 。
5.“汽车尾气污染”问题已备受世人的关注。汽车汽油(辛烷C8H18)引擎若采用电 火花去点燃汽缸中的燃料和空气混合物,汽缸内发生燃烧,燃烧是急速而猛烈的,温度很高。当活塞从汽缸里往外推出时,燃烧的气体跟着在不到百分之一秒的时间内受到膨胀和冷却,因此燃料必有一部分来不及燃烧或不完全氧化。
(1)根据你所学的知识写出汽缸内可能发生的反应的化学方程式。
(2)假设辛烷在汽缸内完全燃烧,则空气质量与辛烷质量之比x值是 。
(3)若空气质量与辛烷质量之比大于x值,则汽车尾气中有害气体含量较多的是 ;若空气质量与辛烷质量之比小于x值,则汽车尾气中有害气体含量较多的是 。
6.美国《科学美国人》杂志在1971年7月刊登的“地球的能量资源”一文中提供了如下数据 :
地球的能量资源数据
|
太阳辐射能的几条主要去路 |
功 率 |
|
直接反射 |
52000×109kJ/s |
|
以热能方式离开地球 |
81000×109kJ/s |
|
水循环 |
40000×109kJ/s |
|
大气流动 |
370×109kJ/s |
|
光合作用 |
40×109kJ/s |
请选用以上数据计算:
(1)地球对太阳能的利用率约为 。
(2)通过光合作用,每年有 kJ的太阳能转化为化学能(每年按365天计)。
(3)每年由绿色植物通过光合作用(6CO2+6H2O C6H12O6+6O2
)为我们生存的环境除去二氧化碳的质量设为A。试根据能量关系列出A的计算式。
C6H12O6+6O2
)为我们生存的环境除去二氧化碳的质量设为A。试根据能量关系列出A的计算式。
列式中缺少的数据用符号表示。
A= (kg)。
所缺数据的化学含义为 。
7.已知卤代烃和氢氧化钠的醇溶液共热可以得到烯烃。如CH3CH3Cl+NaOH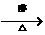 CH2=CH2+NaCl+H2O.现通过以下步骤由
CH2=CH2+NaCl+H2O.现通过以下步骤由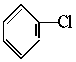 制取
制取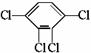 ,其合成流程如下:
,其合成流程如下:
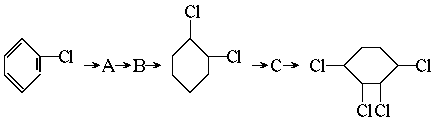 (卤代烃制取烯烃的反应属于消去反应)
(卤代烃制取烯烃的反应属于消去反应)
(1)从左到右依次填写每步所属 的反应类型是(a.取代 b.加成 c.消去反应,只填字母) 。
(2)写出A→B反应所需的试剂和条件 。
(3)写出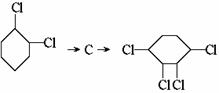 这两步反应的化学方程式
。
这两步反应的化学方程式
。
8.有机物A、B、C、中碳、氢、氧元素物质的量之比为1∶2∶1,它们都能发生银镜反应, 但都不能发生水解反应。B1、B2是B的同分异构体。又知:
A在常温下为气体,A+C6H5OH Z(高分子化合物)
Z(高分子化合物)
B1在16.6℃以下凝为冰状晶体:B1+Na2CO3 X+CO2;X+NaOH
X+CO2;X+NaOH Y(最简单的烃)
Y(最简单的烃)
B2为无色液体,也能发生银镜反应。1 mol C完全燃烧需要3 mol氧气。试回答:
(1)B2的名称 ,A、B的结构简式:A 、B ;
(2)写出X→Y的化学方程式: ;
(3)C的结构简式 ,与C互为同分异构体,且属于乙酸酯类化合物的结构简式 , 。
9.某有机物A的结构简式为:
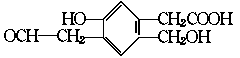
(1)等量的该有机物分别与足量的Na、NaOH、新制Cu(OH)2充分反应时,理论上消耗三种物 质的物质的量之比为 。
(2)A在浓H2SO4作用下,若发生分子内脱水,所生成产物的结构简式为: 。
10.只含有C、H、O的有机物A和B,它们的最简式相同,但A的相对分子质量大于B,将1.50 g A或B完全燃烧后的气体依次通过无水氯化钙和碱石灰,测得分别增重0.90 g、2.20 g;若 A、B以等物质的量混合,取其2.25 g在127℃和1.01×105Pa时气化后体积为1.64L。求:( 1)A、B的最简式。(2)A、B的相对分子质量和分子式。
11.已知有机物A的结构式为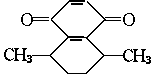 ,其化学式为
。
,其化学式为
。
有机物B是萘的衍生物,且不含-CH3,B与A互为同分异构体,根据要求写出B可能的结构简式并完成下列两问:
(1)与醇能发生酯化反应的是 。
(2)与新制备氢氧化铜在一定条件下作用,产生红色沉淀的是 和 。
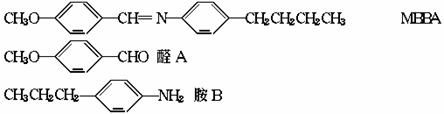
12.液晶是一类新型材料,MBBA是一种研究得较多的液晶化合物,它可以看作是由醛A和胺B 去水缩合的产物。
(1)对位上有-C4H9的苯胺可能有四个异构体,它们是:
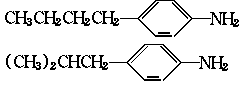
、 。
(2)醛A的异构体甚多,其中属于酯类化合物,而且结构式中的苯环结构的异构体就有六个, 它们是:
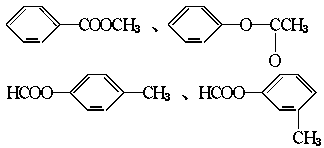
、 。
13.已知
 HOOC(CH2)4COOH,CH3CH=CH2
HOOC(CH2)4COOH,CH3CH=CH2 CH3COOH+CO2,
CH3COOH+CO2,
CH2=CH-CH=CH2+CH2=CH2
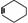
(1)分子式为C17H12的某烃氧化得
HOOC?CH?CH?CH2?COOH
│ │
CH CH
该烃的结构简式 。根据以上事实,可推测该二聚体的结构简式为: 。
(2)已知1,3-丁二烯聚合时,除生成高分子聚合物外,还有一种二聚体生成,且该二聚体发
生下列反应:a.加氢还原,生成乙基环己烷,b.加溴时可引入4个溴原子,c.氧化时可生成 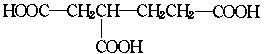 ,同时,还应有一种气体生成,该气体是:
。根据以上事实,可推测该二聚体的结构简式为:
。
,同时,还应有一种气体生成,该气体是:
。根据以上事实,可推测该二聚体的结构简式为:
。
14.已知卤代烃R-X在NaOH水溶液中能发生如下反应:
R-X+NaH R-OH+NaX
R-OH+NaX
现通过如下方法可合成分子量相等的两种有机物F和G。
请回答下列问题:
(1)有机物名称:C 、E 。
(2)上述反应①-⑥ ,属于加成反应的有 。
(3)F和G的相互关系属于 (填序号)
①同系物 ②同分异构体 ③同一物质 ④同一类物质
(4)A+E G的化学方程式为:
。
G的化学方程式为:
。
15.化合物A(C8H8O3)为无色液体难溶于水,有特殊香味,从A出发,可发生图示的一系列反应,图中的化合物A硝化时可生成四种一硝基取代物,化合物H的分子式为C6H6O,G能进行银镜反应。
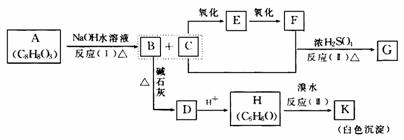
回答下列问题:
A、E、K可能的结构简式
A ,E ,K 。
16.维纶的成分是聚乙烯醇缩甲醛。它可以由乙烯为原料进行合成,其主要步骤是由乙烯氧化和醋酸合成醋酸乙烯酯。化学方程式如下:
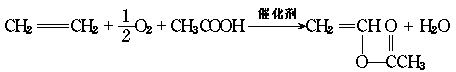
然后经加聚、水解、缩聚制得。请把下列各步变化中指定的有机产物的结构 简式填入空格内:

C4H6O2 (C4H6O2)n (C2H4O)n 维纶(C5H8O2)n
17.不饱和烃可发生催化氧化:
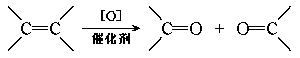
在上述条件下把n mol分子组成都为C5H10的不饱和烃氧化,可得0.4n mol酮和n mo l甲醛以及其他有机产物请填空:
(1)不饱和烃的混合物中,肯定存在的一种烃的结构简式是 ,该烃的物质的量分数 为 。
(2)氧化产物中,除甲醛外,还可能存在的其他有机产物的结构简式 。
(3)在生成高分子化合物
?CH2CH2CH2?CH?CH2?CH2CH=CHCH2?n的三种单体中 ,可能属于上述不饱和烃混合物的
|
CH3CHCH3
一种组分的结构简式为 。
18.将羧酸的碱金属盐溶液电解可得到烃类化合物。例如
2CH3COOK+2H2O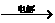
卤代轻具有下列性质:
R-Br+H2O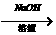 R-OH+HBr
R-OH+HBr
根据下列衍变关系回答有关问题:
ClCH2COOK(溶液)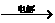 A混合物
A混合物 B
B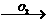 C
C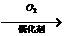 D
D E
E
(1)写出电极反应式:
阳极:
阴极:
(2)写出A→B的化学方程式:
(3)D和B在不同条件下反应,会生成三种不同的E,试写出它们的结构简式:
键状E:
环状E:
高分子E:
19.傅瑞德尔一克拉福茨反应是在苯环上引入烷基的反应: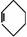 +CH3CH2Cl
+CH3CH2Cl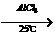
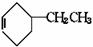 +HCl;乙苯还可发生下列反应:
+HCl;乙苯还可发生下列反应: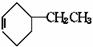
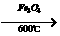
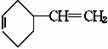 +H2;又已知烯烃与HA加成时,氢原子总是加在含氢较多的不饱和碳上,即:R-CH=CH2 +HA
+H2;又已知烯烃与HA加成时,氢原子总是加在含氢较多的不饱和碳上,即:R-CH=CH2 +HA R-CH-CH3试以电石、 苯等为原料制备苯乙醇
R-CH-CH3试以电石、 苯等为原料制备苯乙醇
|
A
(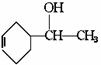 ),写出各步反应的化学方程式:
),写出各步反应的化学方程式:
(1) ; (2) ;
(3) ; (4) ;
(5) ; (6) ;
(7) 。
20.取3.320 g只含羧基,不含其他官能团的固态芳香族羧酸置于4L氧气中,经点燃,羧酸 完全燃烧。反应后气体体积增加0.224 L。将气体通过足量的固体Na2O2后,体积减小1. 792 L(所有体积均为标准状况下测定)。请回答:
(1)3.320 g该羧酸中C、H、O三元素的物质的量;
(2)写出该羧酸的最简式;
(3)写出符合以上条件的相对分子质量最小的芳香族羧酸的结构简式。
21.1 mol某饱和烃的含氧衍生物A与2 mol NaOH在一定条件下恰好完全反应,生成1 mol 钠 盐。A的相对分子质量不超过120,氧的质量分数不超过0.543。试回答以下问题:
(1)A的一个分子中至少有 个氧原子。
(2)A的分子式是 。
(3)A有 种可能的不同结构。其中能通过简单试管实验鉴别出来的是 。
(4)1 mol A与2 mol NaOH反应,生成1 mol钠盐外还可能生成 。(可填满也可不填满)。
22.由三种化合物组混合物X,组成它的三种化合物A、B、C互为同分异构体,经实验测得下 列结果:
(1)X在标准状况下的密度为2.679 g/L;
(2)把1.8g X完全燃烧得3.96g CO2和2.16g H2O,无其他燃烧产物;
(3)2.0g X与Na反应生成标准状况下的H2 149mL,此时C不反应而残留;
(4)取2.0g X用酸性KMnO4溶液氧化,其中A氧化的最终产物不与Na2CO3反应;B氧化的最终产物0.74 g,可与Na2CO3反应放出气体。
试确定A、B、C的结构简式及物质的量之比。
23.已知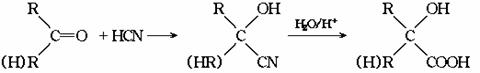
有机玻璃可按下列路线合成:
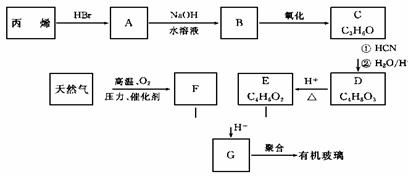
F亦可由水煤气在高温、高压、催华剂存在下合成。试写出:
(1)天然气的主要成分和C的结构简式分别为 、 。
(2)E+F G的反应方程式为
。
G的反应方程式为
。
(3)丙烯 A和A
A和A B的反应类型分别属于
、
。
B的反应类型分别属于
、
。
(4)G 有机玻璃的反应方程式为:
。
有机玻璃的反应方程式为:
。
24.石油及其分馏产物在供氧不足时燃烧,常常产生CO,这也是常见的大气污染物之一。将某气态烃在5倍体积的纯氧中燃烧,产物通过足量Na2O2,并在电火花连续作用下充分反应,生成的气体体积缩小到燃烧产物体积的3/8(气体体积都在100℃以上,1.01×105Pa时测定)。
(1)试写出通式为CxHy的某烃在供氧不足时燃烧的化学方程式。
(2)若(1)反应中,生成m mol CO2,则当m=2时该烃的分子式。
(3)若1 mol某气态烃在供氧不足时燃烧,产物在足量Na2O2和电火花连续作用下产生3 m olO2,且固体Na2O2增重范围为90 g≤ΔW≤118 g,求烃可能的分子式和燃烧产物CO 与CO2的物质的量之比,将结果填入下表。
|
烃的分子式 |
n(CO)∶n(CO2) |
|
|
|
25.在国际环境问题中,一次性使用的聚苯乙烯材料所带来的“白色污染”问题甚为突出。 德国Danone公司开发出具有60天自行降解功能的绿色食品杯--聚乳酸(分子组成可表示为C 3nH4n+2O2n+1)包装材料。
(1)聚苯乙烯为什么会造成“白色污染?” 。
(2)乳酸可以从甜菜发酵的糖液中提取,然后通过 反应生成聚乳酸。合成聚乳酸的 化学方程式为 。
(3)聚乳酸的降解可分为两个阶段,首先是化学水解成乳酸单体,然后乳酸单体在微生物的 作用下分解,生成二氧化碳和水。聚乳酸自行降解的两步反应的方程式为 。(经测定,聚乳酸材料分子结构中含支链)
26.(1)人类所使用的能量绝大部分来源于太阳能。捕获太阳能的生物主要为绿色植物。绿 色植物能够通过光合作用把太阳能转变为化学能。写出光合反应的化学方程式: 。
(2)煤、石油、天然气等能源以热的形式供给人们需要的能量,试以它们各自的主要成分C、 CnH2n+2和CH4为代表,写出它们燃烧过程的化学方程式:
(3)大气中二氧化碳的增多会造成温室效应。指出煤、石油、天然气这三种物质在质量相同时,哪一种燃料对环境造成负面影响最小?
27.1976年P.Inoue报道用Pd-磷化物催化二氧化碳和丁二烯的反应,可得的产物之一是:
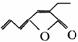
若有机物乙与甲互为同分异构体,乙能与FeCl3溶液作用显紫色,且分子结构中不存在甲 基,乙与适量新Cu(OH)2的悬浊液在加热的条件下,反应可产生砖红色的沉淀,则:
(1)有机物甲的分子式为 .
(2)在一定条件下,能跟1 mol乙起加成反应的H2的最大用量为 mol.
(30若常温下与1 mol乙起取代反应需消耗Br2的最大用量为2mol,写出有机物乙可能的结构 简式 .
28.已知丙二酸(HOOC-CH2-COOH)用P2O5脱水得到的主要产物的分子式是C3O2,它跟水加成仍得丙二酸.C3O2是一种非常“活泼”的化合物,除能跟水加成生成丙二酸外,还能跟NH3、HCl、ROH(R为链烃基)等发生加成反应.例如C3O2跟NH3加成:C3O2+2NH3 CONH2
CONH2
|
CH2
|
CONH2
试写出:
(1)C3O2的结构简式:
(2)C3O2分别跟HCl、CH3CH2OH发生加成反应的化学方程式: ,
.
29.下面是某研制人员为合成药物苯氟布洛芬所设计的线路.
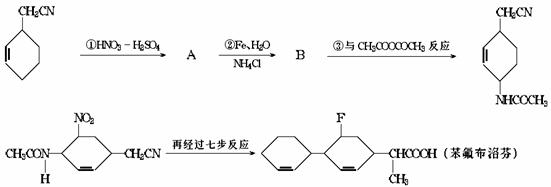 回答下列问题:
回答下列问题:
(1)苯氟布洛芬的分子式为 .
(2)物质A、B的结构简式分别为 , .
(3)反应①-④中属于取代反应的是 (填反应代号).
(4)写出反应③的化学方程式(有机物写结构简式): .
30.乙酸跟乙醇在浓硫酸存在并加热的条件下发生的酯化反应(反应A),其逆反应是水解反 应(反应B)。反应可能经历了中间体(I)这一步。
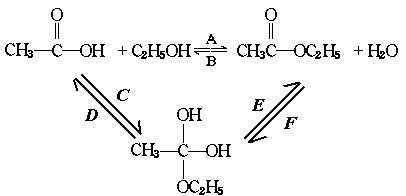
(Ⅰ)
(1)如果将反应按加成、消去、取代反应分类,则A-F6个反应中(将字母代号填入下列空格 中),属于取代反应的是 ;属于加成反应的是 ;属于消去应的是 。
(2)如果使原料C2H5OH,用18O标记,则生成物乙酸乙酯中是否有18O?如果使原料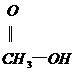 中羰基(
中羰基(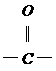 )
)
或羟基中的氧原子用18O标记,则生成物H2O中氧原子是否有18O?试简述你作此判断的理由。
(3)在画有圈号的3个碳原子中,哪一个(或哪些)碳原子的立体形象更接近甲烷分子中的碳原 子?试述其理由。
31.紫杉醇是一种新型搞癌药,其分子式为C47H51NO14,它是由如下的A酸和B醇生成的一种酯。
A.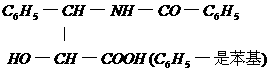
(1)A可以在无机酸催化下水解,其反应方程式是
(2)A水解所得的氨基酸不是天然蛋白质水解产物,因为氨基不在(填希腊字母) 。
(3)写出ROH的分子式 位。
32.维生素C是一种水溶性维生互(呈酸性),分子式为C6H8O6,人体缺乏这种维生素能 患坏血症,所以维生素C人称抗坏血酸。维生素C易被空气中的氧气氧化,加热易变质。在新 鲜的水果、蔬菜中都富含维生素C,新鲜橙汁中维生素C的含量在500mg·L-1左右。
校外活动小组测定某品牌的软包装橙汁中维生素C的含量,下面是测定实验分析报告。请填 写有关空白:
(1)测定目的:测定某品牌软包装橙汁中维生素C的含量
(2)测定原理:C6H8O6+I2 C6H6O6+2H+2I-
C6H6O6+2H+2I-
(3)实验用品及试剂:①仪器和用品(略)
②试剂:7.5×10-3mol·L-1标准碘溶液,指示剂 (填名称),蒸馏水等。
(4)实验过程:
①洗涤检查滴定管是否漏液,润洗后装好标准碘溶液待用。
②打开橙汁包装,用 (填仪器名称)向锥形瓶移入20.00mL待测 橙汁,滴入2滴指示剂。
③左手控制滴定管的 (填部位),右手摇动锥形瓶,眼睛注视 直到滴定终点,滴定点的现象是 。
33.下面是一个四肽,它可以看做是4个氨基酸缩合掉3水分子而得。
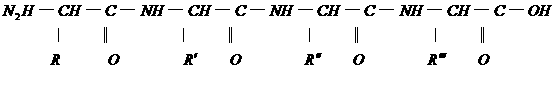 式中,R、R′、R″、
式中,R、R′、R″、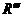 可能是相同的或不同的烃基,或有取代基的烃基。
可能是相同的或不同的烃基,或有取代基的烃基。
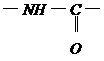 称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后得到下列四种氨基酸:
称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后得到下列四种氨基酸:
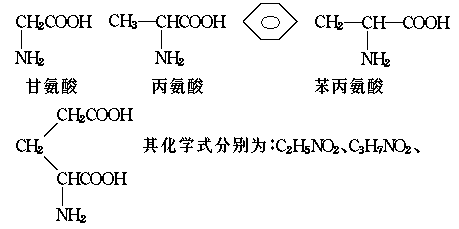
谷氨酸
C9H11NO2、C5H9NO4
问:(1)这个“多肽”是几肽?
(2)该多肽水解后,有几个苯丙氨酸?
(一)选择题
1.由两分子乙炔聚合得到CH2 CH-C≡CH,继续和氯化氢加成得到CH2=CH-CCl=CH2,所得产物加成聚合后得到354g?CH2CH=CClCH2?n,则所需乙炔的质量为( )
CH-C≡CH,继续和氯化氢加成得到CH2=CH-CCl=CH2,所得产物加成聚合后得到354g?CH2CH=CClCH2?n,则所需乙炔的质量为( )
A.624g B.416g C.312g D.208g
2.足球运动员在比赛中腿部受伤时医生常喷洒一种液体物质使受伤部位皮肤表面温度骤然下降,减轻伤员的痛感。这种物质是( )
A.碘酒 B.氟里昂 C.氯乙烷 D.酒精
3.苯环结构中不存在C-C单键和C=C双键的简单交替结构,可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色;②苯环中碳碳键的键长均相等;③苯能在催化剂存在和加热的条件下氢化生成环己烷;④邻二甲苯只有一种结构;⑤苯在FeBr3存在下同液溴发生取代反应,但不因化学反应而使溴水褪色。
A.②③④⑤ B.①③④⑤ C.①②④⑤ D.①②③④
4.具有解热镇痛作用的阿斯匹林的结构简式为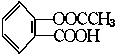 在适宜的条件下,阿斯匹林可能发生的反应有( )
在适宜的条件下,阿斯匹林可能发生的反应有( )
①消去反应,②酯化反应,③银镜反应,④加成反应,⑤水解反应,⑥中和反应。
A.①②③④ B.①③⑤ C.②④⑥ D.②③④⑤⑥
5.某物质中可能有甲酸、乙酸、甲醇和甲酸乙酯4种物质中的一种或几种,在鉴定时有下 列现象:①可发生银镜反应;②加入新制Cu(OH)2悬浊液沉淀不溶解;③与含酚酞的NaOH 溶液共热发现溶液中红色逐渐消失以至无色。下列叙述中正确的是( )
A.有甲酸和甲酸乙酯 B.有乙酸和甲酸乙酯
C.可能有甲醇,一定有甲酸乙酯 D.几种物质都有
6.已知柠檬醛的结构简式为 ,根据已有知识判定下列说法不正确的是( )
,根据已有知识判定下列说法不正确的是( )
A.它可使酸性高猛酸钾溶液褪色
B.它可跟银氨溶液反应生成银镜
C.它可使溴水褪色
D.它被催化加氢的最后产物的分子式是C10H20O
7.萘环上的位置可用α、β表示,如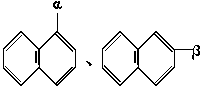 。下列化合物中α位有取代基的是( )
。下列化合物中α位有取代基的是( )

8.已知和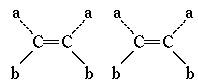 两结构式( a、b分别代表不同的原子或原 子团)互为同分异构体,推断一氯丙烯的同分异构体(不含环状结构)共有( )
两结构式( a、b分别代表不同的原子或原 子团)互为同分异构体,推断一氯丙烯的同分异构体(不含环状结构)共有( )
A.3种 B.4种 C.5种 D.6种
9.从柑桔中炼制萜二烯(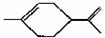 ),下列有关它的推测 正确的是( )
),下列有关它的推测 正确的是( )
A.分子式为C10H16
B.常温下为液态,难溶于水
C.其一氯代物有10种
D.与过量的溴的CCl4溶液反应后产物为
10. amL三种气态烃的混合物和足量的氧气混合点燃爆炸后,恢复到原来的状态(常温常压),气体体积共缩小2a mL(不考虑二氧化碳的溶解)。则三种烃可能的组合是( )
A.CH4、C2H4、C3H4任意体积比
B.CH4、C3H6、C2H2保持C3H6∶C2H2=1∶2(物质的量之比)
C.C2H6、C4H6、C2H2同条件下体积比为2∶1∶2
D.C3H8、C4H8、C2H2质量比为11∶14∶16
11.有机物甲C3H6O3在适当条件下,每两个分子甲可相互发生酯化反应,生成一分子 乙,则乙的结构式不可能是( )
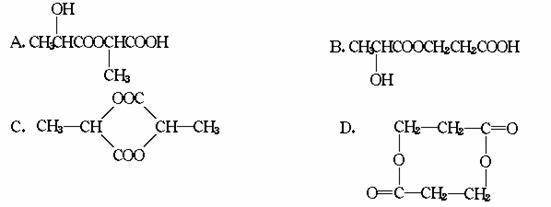
12.烯烃在一定条件下发生氧化反应时,C C双键发生断裂,RCH
C双键发生断裂,RCH CHR′可以氧化成RCHO和R′CHO。下列烯烃分别被氧化后,产物中有乙醛的是( )
CHR′可以氧化成RCHO和R′CHO。下列烯烃分别被氧化后,产物中有乙醛的是( )
A.CH2 CHCH2CH2CHCH3
B.CH3CH2CH
CHCH2CH2CHCH3
B.CH3CH2CH CHCH2CH3
CHCH2CH3
C.CH3CH CHCH2CH2CH3
D.CH3CH
CHCH2CH2CH3
D.CH3CH CHCH
CHCH CHCH3
CHCH3
13.一定量的有机物与足量的金属钠反应,生成xL气体,在相同条件下等量的该有机物与足量的NaHCO3溶液反应生成y L气体,已知x>y,则该有机物可能是( )

14.将一定量有机物充分燃烧后的产物通入足量石灰水中完全吸收,经过滤得到沉淀20 g ,滤液质量比原石灰水减水5.8 g。该有机物可能是( )
A.乙烯 B.乙二醇 C.乙醇 D.甲酸甲酯
15.某共价化合物含碳、氢、氮三种元素,分子内有四个氮原子,且四个氮原子构成正四面体(如白磷结构),每两个氮原子间都有一个碳原子。已知分子内无碳碳单键,也没有碳碳双键,则该化合物的分子式为( )
A.CH8N4 B.C6H12N4 C.C6H10N4 D.C4H8N4
16.在石油化工生产中,用于制造合成塑料、合成纤维、有机溶剂等重要的基础原料的是( )
A.天然气 B.乙烯 C.电石 D.酒精
17.漆酚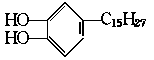 是我国特产生漆的主要成分,通常情况下为黄色液体,能溶于有机溶剂,生漆涂
在物体的表面,在空气中干燥后变成黑色的漆膜。将漆酚放入下列物质中:①空气,②溴水 ,③小苏打溶液,④氯化铁溶液,⑤通入过量的二氧化碳,不能发生化学反应的是( )
是我国特产生漆的主要成分,通常情况下为黄色液体,能溶于有机溶剂,生漆涂
在物体的表面,在空气中干燥后变成黑色的漆膜。将漆酚放入下列物质中:①空气,②溴水 ,③小苏打溶液,④氯化铁溶液,⑤通入过量的二氧化碳,不能发生化学反应的是( )
A.①②⑤ B.③④ C.②⑤ D.③⑤
18.食用下列物质不会引起中毒的是( )
A.甲醇兑制的白酒
B.用于混凝土防冻的亚硝酸钠
C.用碳酸钡作X射线的“钡餐”
D.加碘盐(含碘酸钾的食盐)
19.1995年3月20日,日本东京地铁发生了震惊世界的“沙林”毒气袭击事件,造成12人死亡、5000多人受伤,恐怖分子使用的“沙林”是剧毒的神经毒气,其结构简式为
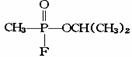 。已知
。已知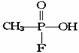 的名称为甲氟磷酸,则“沙林”的化学名称为( )
的名称为甲氟磷酸,则“沙林”的化学名称为( )
A.甲氟磷酸异丙醚 B.甲氟磷酸异丙酯
C.甲基异丙基氟磷酸 D.甲氟异丙氧基磷酸
20.有机物丁香油酚结构简式为: 其可能具有的性质是:
其可能具有的性质是:
①能发生加成反应,②能使酸性高锰酸钾溶液褪色,③能发生取代反应,④能与三氯化铁发生显色反应,⑤能发生中和反应,⑥能发生消去反应
A.全部 B.仅①②③④ C.除⑥外都能 D.除④⑥外都能
21.有关专家指出,目前家庭装修中常用的板材、涂料、石材、布艺或多或少都存在毒性, 其毒性来源为( )
A.甲烷 B.甲酸 C.甲醇 D.甲醛
22.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应 物中原子全部为欲制得的产物,即原子利用率为100%.在用CH3C≡CH合成CH2=C(CH3) COOCH3的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
A.CO和CH3OH B.CO2和H2O
C.H2和CO2 D.CH3OH和H2
23.稀土是我国的丰产元素,17种稀土元素性质非常接近,用有机萃取剂来分离稀土元素是一种重要的技术.化合物A是其中一种,有机萃取试剂A的结构式如下:
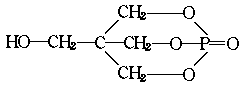
据你所学的知识判断A属于( )
A.酸类 B.酯类 C.醛类 D.油脂类
24.1993年由中国学者和美国科学家共同合成了世界上最大的碳氢分子,其一个分子由1334 个碳原子和1146个氢原子构成.关于此物质,下列说法肯定错误的是( )
A.属烃类化合物 B.常温下是固态
C.可发生氧化、加成反应 D.具有类似金刚石的硬度
25.巴豆酸的结构简式为CH3-CH=CH-COOH.现有①氯化氢、②溴水、③纯碱溶液、④2-丙醇、⑤酸化的KMnO4溶液.试根据其结构特点,判断在一定条件与巴豆酸反应的物质的组合是( )
A.只有②④⑤ B.只有①③④ C.只有①②③④ D.①②③④⑤
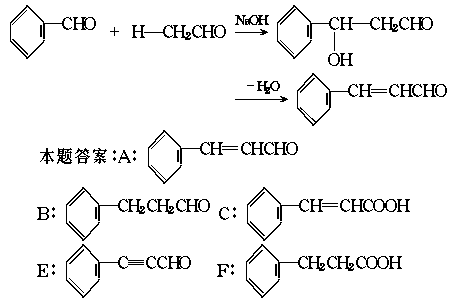
例1 A是一种可以作为药物的有机化合物。请从下列反应图式中各有机物的关系(所有无机物均已略去),推测有机物A、B、C、E、F的结构简式。

解析 本题图式中根据标注的反应条件,可以十分容易判断A→C发生银镜反应,C→D发生溴的加成反应,C→E发生卤代烃的消去反应,但苯甲醛和乙醛在NaOH溶液中生成A的反应,课本中不曾学过,从A经一系列反应可得到含9个碳原子的E,再联想到C O双键的加成反应,综合各种信息,可以推测这是一个加成消去反应。即
O双键的加成反应,综合各种信息,可以推测这是一个加成消去反应。即
例2 白藜芦醇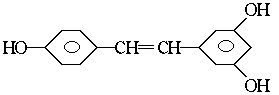 ,广泛存在于食物(例如桑椹、花生,尤其是葡萄)中。它可能具有抗癌性。该物质和溴水或 氢气反应时,能够跟1 mol 该化合物起反应的Br2或H2的最大用量分别是
mol。
,广泛存在于食物(例如桑椹、花生,尤其是葡萄)中。它可能具有抗癌性。该物质和溴水或 氢气反应时,能够跟1 mol 该化合物起反应的Br2或H2的最大用量分别是
mol。
解析 白藜芦醇是中学化学中不曾接触到过的一种物质,但从题中提供的结构简式分析,该物质属于酚类,我们就可以将已学过的关于酚的性质的有关知识加以迁移,在新情境中去解决问题。
回忆苯酚和浓溴水的反应: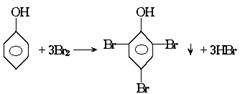
溴原子只能取代羟基邻、对位上的氢原子,若反应前这些位置已被其他的原子团所占有,则这些部位已无氢原子可取代,如结构为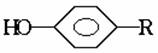 的酚和溴水发生取代反应时生成物应为
的酚和溴水发生取代反应时生成物应为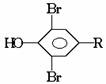 ;结构为
;结构为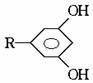 的酚和溴水发生取代反应时生成物应为
的酚和溴水发生取代反应时生成物应为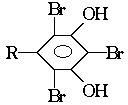 ,白藜芦醇分子
中还含有C=C不饱和键还能和溴水中的溴水发生加成反应,而白藜芦醇和氢气发生的是加成反应,其加成部位是二个苯环和一个C
,白藜芦醇分子
中还含有C=C不饱和键还能和溴水中的溴水发生加成反应,而白藜芦醇和氢气发生的是加成反应,其加成部位是二个苯环和一个C C键。
C键。
本题答案:6 mol和7 mol
例3 在20℃时,某气态烃与氧气混合装入密闭容器中,点燃爆炸后,又恢复到20℃。此时容器内气体的压强为反应前的一半,经NaOH溶液吸收后,容器内几乎真空。此烃的化学式可能是( )
A.CH4 B.C3H4 C.C2H4 D.C3H8
解析 依题意,气态烃与氧气恰好完全反应,利用有关反应式:CxHy+(x+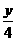 )O2
)O2 xCO2+
xCO2+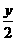 H2O,在相同条件下,
反应前后压强之比等于反应前后物质的量比。
H2O,在相同条件下,
反应前后压强之比等于反应前后物质的量比。
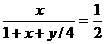 化简:y=4(x-1) 讨论:①当x=1 时,y=0舍去;②当x=2时,y=4;③当x=3时,y=8.答案:C、D.
化简:y=4(x-1) 讨论:①当x=1 时,y=0舍去;②当x=2时,y=4;③当x=3时,y=8.答案:C、D.
例4 已知维生素A的结构简式如下:
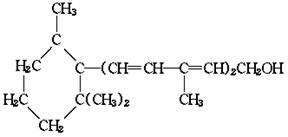
关于它的说法正确的是( )
A.维生素A是一种酚
B.维生素A是一个分子中含有三个双键
C.维生素A的一个分子中有30个氢原子
D.维生素A具有环已烷的结构单元
[解析]由于维生素A无苯环上的羟基,所以A错误;显然分子中含五个双键 ,所以B错误;分子中六元环含双键,所以D错误.利用数碳算氢的方法可得答案应为C.
[答案]C
例5 中草药秦皮中含有的七叶树内酯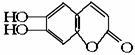 (碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
(碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
A.3mol Br2;2mol NaOH B.3mol Br2;4mol NaOH
C.2mol Br2;3mol NaOH D.4mol Br2;4mol NaOH
[解析]本题要求学生在理解酚和酯的结构及其性质的基础上,将获取的有关规律迁移到题 目所指定的有机物中。由于学生在课本中学习的是一元酚和普通酯,而题设物质却是一种既 可以看成二元酚,又可看成酯(内酯)且含有双键的复杂有机物,所以本题在考查相关知识点 的同时,也在一定程度上考查学生思维的灵活性、广阔性和创造性。
仔细观察该有机物的结构简式并结合已有知识,不难得知:1mol七叶树内酯可与3mol Br2 相作用,其中2mol Br2 用于酚羟基的邻位氢的取代(注:对位无氢可取代),1mol用于酯环上双键的加成,其反应原理为:
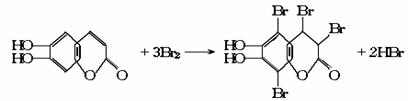
当1mol七叶树内酯与NaOH反应时,需4mol NaOH,其中3mol NaOH与酚羟基(包括水解后生成 的)作用,1mol NaOH与水解后产生的羧基发生中和反应,其反应原理为:
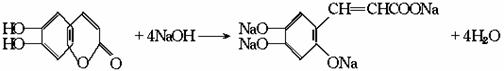
答案:B
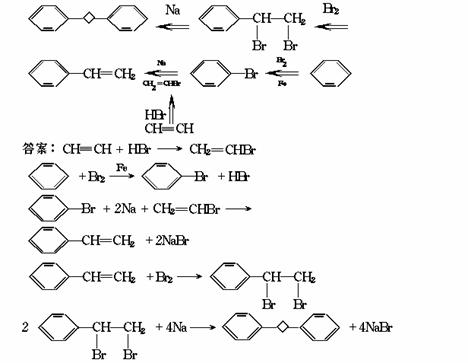
例6 一卤代烃RX与金属钠作用,可增加碳链制高级烷,反应如下:
2RX+2Na R-R+2NaX
R-R+2NaX
试以苯、乙炔、Br2、HBr、钠主要原料,制取

[解析]本题是以武慈反应为知识背景的有机合成题。旨在考查学生自学能力和综合运用知 识的能力。由于涉及反应较多,合成路线又不易直接看出,所以题目有一定难度,能力测试 层次属于综合应用。
本题宜用逆向合成法,解题的关键是首先做好“合成设计”。其基本思路是:根据已有原料 和有关反应规律,尽可能合理地把目标分子(产品)通过生成它的反应与前一个中间产物联系 起来,再把这个中间产物通过生成它的反应与上一个中间产物联系起来……直至追溯到原为 为止。待合成时,再“反其道而行之”。
根据上述思路,可制定出本题的合成路线:
5.将化学问题抽象成数学问题,利用数学工具,通过计算(结合化学知识)解决化学问题的能力。
4.要重视有机化学实验的复习,不仅要掌握“规定实验”的原理、药品、装置和操作步骤, 还要具有观察、记录实验现象、分析实验结果、得出正确结论的能力;初步处理实验中有关安全问题的能力;识别和绘制典型实验仪器装置图的能力以及根据试题要求,设计简单实验方案的能力。
3.把握各种官能团的结构特点和性质特征,并懂得官能团决定性质、性质反映官能团,不同官能团可以相互影响,并且在一定条件下可以相互转化的辩证关系,培养自己的逻辑思维能力和应用理论解决实际问题的能力。
2.在复习中要培养自我获取知识、自我加工、贮存知识,并能随时调用这些知识独立解决问题的能力。
为了适应高考的新趋势,在有机化学复习中应立足课本,发展智力,培养能力,必须向能力 (观察能力、实验能力、思维能力和自学能力)测试倾斜具体讲,应做到:
1.对中学化学应掌握的内容能融会贯通,将知识横向和纵向统摄整理,使之网络化,有序地贮存,作“意义记忆”和抽象的“逻辑记忆”,有正确复述,再现、辨认的能力。
18.聚氯乙烯[(CH2CHCl)n]是最早工业化生产的重要塑料品种之一,其具有价格低廉、难燃烧等优点,因此产量仅次于聚乙烯居第二位,约是世界热塑性塑料产品的23%。但是,其加工过程需要使用许多有毒添加剂。有毒的添加剂会渗出对人类造成危害;另外,其燃烧值低,聚乙烯[(CH2CH2)n]等烯烃聚合物废物燃烧产生的能量与燃油相当,而聚氯乙烯产生的能量仅与纸张相当,且有剧毒的二恶英的深沉(二恶英是目前对人类最毒的物质)。
(1)计算聚氯乙烯中氯的质量分数(相对原子质量数据:氯-35.5;氢-1;碳-12;)。
(2)聚氯乙烯、聚乙烯的原料都是石油。其中。聚乙烯中的CH2=CH2都是来自石油;而聚氯乙烯中的CH2=CHCl,除来自石油外,还有HCl。现有1吨石油,试计算可得到多少吨聚乙烯和聚氯乙烯(理论上假设石油的全部成分为碳和氢,并且在生产聚乙烯、聚氯乙烯的过程中没有碳原子和氢原子的损失)。
(3)如果地球目前所蕴藏的石油全部生产聚乙烯仅可以用50年,则生产聚氯乙烯可以用多少年?
(4)试根据上述信息及计算结果,谈谈人类该如何对待聚氯乙烯的使用。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com