
题目列表(包括答案和解析)
5.化学反应速率,化学平衡及其应用。
4.氧化还原反应的概念;氧化性还原性相对强弱的判断,氧化还原反应的规律及其应用。
3.物质结构与元素周期律:重点掌握元素的原子量,同位素知识;典型元素的原子核外电子的排布规律、电子式的书写及原子稳定结构的判断;元素周期表中结构、位置、性质三者间的关系;未知元素及其化合物的预测;分子结构、化学键类型、微粒结构及半径大小比较;四种晶体类型的识别、微粒间相互作用的实质及物理性质的明显差异;三维空间物质结构等。
2.阿伏加德罗常数、阿伏加德罗定律及其应用。
化学的基本概念是中学化学最关键的中心内容,化学基础理论是贯穿于中学化学的一条主线,准确理解和掌握化学“双基”是学好化学的基础,是提高综合、分析能力的前提条件。化学基本概念和基础理论所包含的内容多,主要包含以下几个方面的知识:
1.物质的分类及基本化学反应的类型。
26.(12分)著名的”侯氏制碱法” 第一步反应是向饱和氨化食盐水中通入二氧化碳,该反应可表示为: CO2 +H2 O + NaCl + NH3 -- NaHCO3 +NH4Cl
有关物质的溶解度数据如下 :(g/100gH2O)
|
|
NaCl |
NaHCO3 |
NH4Cl |
|
100C |
35.8 |
8.15 |
33.0 |
|
450C |
37 |
14.0 |
50.0 |
在450C时,向434g饱和食盐水中通入适量氨气,再向其中通入二氧化碳后,按上述反应进行完全。试计算下列问题:
⑴反应完全后,450C时析出晶体的化学式是 -,析出晶体的质量为 。
计算过程:
⑵过滤除去晶体后再降温到100C,此时析出晶体化学式是 -,析出晶体质量是 。
25.(8分)已知下列两个热化学方程式;H2(g)+ O2(g)==== H2O(l ); △H= -285.8kJ/ mol
O2(g)==== H2O(l ); △H= -285.8kJ/ mol
C3H8(g)+5O2(g) ==== 3CO2(g) +4H2O(l) ; △H= -2220.0 kJ/ mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热5297.4kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(l)=H2O(g);△H=+44.0 kJ/ mol 。
试写出丙烷燃烧生成CO2和水蒸气时的热化学方程式。
24.有机物A-H能发生下图所示一系列变化
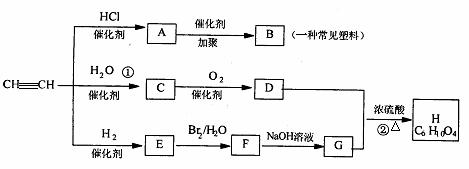
试回答下列:
(1)写出化学式:A __________;B__________; C_________; D _________。
(2)写出化学方程式: ①____________________________________ ;
②______________________________ 。
23.(8分)某无色溶液可能是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe(SO4)3、(NH4)2SO4溶液中的两种或两种以上混合而成。取该溶液,向其中加入稀硫酸,有白色沉淀生成;继续加入稀硫酸,沉淀又完全消失,整个实验过程中无气体产生。
(1)原溶液是由 和 溶液混合而成的。
(2)整个过程中,有关反应的离子方程式是 、
、 。
22.(本小题共8分)
(1)已知氢氧化铁可以被次氯酸钠氧化成FeO4n-,当3.21gFe(OH)3参加反应时,反应中共转移了5.418×1022个电子,则n= ,FeO4n-中铁的化合价为 。
(2)根据上题推断结果,配平下列离子方程式:
[ ]Fe(OH)3+ [ ]ClO- + [ ]OH--- [ ]FeO4n-+[ ]Cl-+[ ]H2O
(3)结合以上反应,推测FeO4n-能与下列哪些物质反应(填序号) 。
A.Cl2 B.SO2 C.H2S D.O2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com