
题目列表(包括答案和解析)
(1)S + KNO3 + C = K2S + N2 + CO2
(2)Cu + FeCl3 = FeCl2 + CuCl2
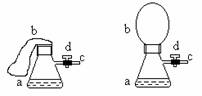
27.图(1)中瓶a内放入20毫升6摩/升盐酸,b是未充气的气球,里边放有4克碳酸钙粉未,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图(1)的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:
(1)把气球b中的碳酸钙粉末小心地倒入瓶中,立即产生许多气泡,气球逐渐胀大(图Ⅱ).反应结束后,再次称量,质量为W2克.则W2和W1的关系是 .
(2)取25毫升6摩/升NaOH溶液.先用滴管取少量NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气).打开d,将溶液挤入瓶中,立即夹紧d.可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失.用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失.使沉淀消失的反应的化学方程式是 .

不再溶解.此时瓶内温度 (填"不变"、"降低"或"升高").
(4)继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状.写出这时发生的反应的化学方程式 .
26.原硅酸通过分子间缩水聚合可形成不同的多硅酸(多聚体),如:
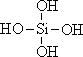
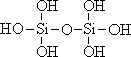
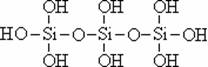
原硅酸 二聚体 三聚体
 则原硅酸的化学式是 ,原硅酸二聚体的化学式是 , 按上述规律,n个原硅酸聚合而成的链状多酸分子的通式是 。
则原硅酸的化学式是 ,原硅酸二聚体的化学式是 , 按上述规律,n个原硅酸聚合而成的链状多酸分子的通式是 。
25.硅化氢(SiH4)在空气中能自燃,根据甲烷燃烧的化学方程式,写出硅化氢自燃的化学方程式 。此反应中硅化氢是 (得到,失去)电子,作为 剂。
24.工业上制取粗硅的化学反应式是 。
23.滑石[Mg3(Si4O10)(OH)2]改写为氧化物形式表示可写成____________。
22.工业上制造普通玻璃的主要原料是 、 、_____,
主要原料熔化后,发生的主要化学反应是(1) ,(2) 。普通玻璃的成份是 。
21.在碳族元素中,非金属性最强的元素是_______,金属性最强的元素是_______,单质能作半导体的元素是_______,+2价最稳定的元素是 ,气态氢化物最稳定的是_______,最高氧化物水化物酸性最强的是________。
20、下列各组物质的熔点均由高到低排列,其原因是由于键能由大到小排列的是( )
A.钠、铝、干冰 B.金刚石、碳化硅、晶体硅
C.碘化氢、溴化氢、氯化氢 D.二氧化硅、二氧化碳、一氧化碳
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
19.将过量的CO2通入下列溶液中,最终出现沉淀的是 ( )
(1) .CaCl2溶液 (2) .石灰水 (3) .饱和Na2CO3 (4) .水玻璃
A. (1) (3)(4) B. (2)(3) C.(3)(4) D.(1)(3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com