
题目列表(包括答案和解析)
1] (1)中和滴定 测定氨水的物质的量的浓度 标准盐酸 甲基橙试液 (2)用洁净的玻璃棒蘸取氨水,滴在pH试纸上,将试纸与标准比色卡相比较,从而测定此氨水的pH值 (3)该氨水的电离度a=10α-14/c×100%
1] (1)最慢 相等 (2)慢 相等 (3)快 相等 (4)最快 最少 (2)(3)(4)比(1)快是因为Zn-Cu原电池,(3)(4)比(2)快Cu面积大,(4)比(3)快是Cu面积更大,均匀。 (4)中发生Zn置换少量Cu2+的反应。
7. 某学生要用浓硝酸法(测定反应生成气体的量)测定某铜银合金中铜的质量分数。资料表明:①反应中除生成NO2气体外,还会有少量NO生成; ②常温下NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体(或晶体)存在。为完成测定并验证确有NO生成,该学生设计的实验装置如下图,试回答:
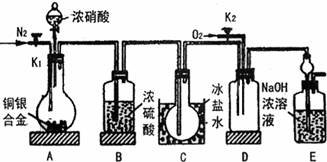
(1) 实验前要先打开A装置的活塞K1,通入一段时间氮气后再关闭K1其目的和原因是 。
(2) 装置B的作用是 。
(3) 实验时A中反应停止后,打开D装置导管的活塞K2并通入氧气,若反应确有NO产生,D中的现象是 ;实验时发现通入氧气温度的高低对实验有较大的影响,为便于观察应通入 (填“冷”或“热”)的氧气,其原因是(用所学过的理论知识解释):
___________________________________________________________________.
(4) 为减小测量误差,在A中反应完成和D中出现现象后,还应进行的操作是:
(5) 若设反应中硝酸无挥发也无分解,且溶液的体积变化忽略不计,实验已测得以下数据:铜银合金的质量、浓硝酸的物质的量浓度及体积(过量)、E装置反应生成物中氮元素的质量;为确定合金中铜的质量分数,还需测定的数据是:
______________________________________________________.
(6) 若实验只测定Cu的质量分数,不检验NO的产生,则在铜银合金与浓硝酸反应后,只需简单实验操作(不使用B-E连续装置)就可达目的,简述实验过程:
.
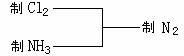 8. 某探究性学习小组在查阅资料中发现,常温下氯气可以氧化氨气获得氮气。该小组由此设计出制取氮气的思路:
8. 某探究性学习小组在查阅资料中发现,常温下氯气可以氧化氨气获得氮气。该小组由此设计出制取氮气的思路:
实验室现有如下试剂及仪器(见图):
试剂: ①饱和食盐水 ②浓硫酸 ③浓硝酸 ④浓盐酸 ⑤碱石灰 ⑥二氧化锰 ⑦浓氨水
仪器:

请完成下列各题:
(1) 写出制取N2的化学方程式 ,反应生成0.5mol N2,转移的电子数是 mol。
(2) 用以上仪器(可重复使用)连接成制纯净C12、NH3的装置,按照前后顺序把图的编号填入下表中,并写出对应仪器里试剂的编号。(下列空格不一定填满)
|
制Cl2 |
仪器 |
|
|
|
|
试剂 |
|
|
|
|
|
制NH3 |
仪器 |
|
|
|
|
试剂 |
|
|
|
(3) 当反应装置里的氨气和氯气的物质的量之比大于 时,尾气里一定含有氨气:当反应装置里的氯气和氨气的物质的量之比大于 时,尾气里一定含有氯气。
6. 如图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其它用途:
(1) 医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装盛有水的装置,用于观察气泡产生的情况,以便调节供氧速率,此时氧气应从 (填标号,下同)管口通入。
(2) 实验室用MnO2与浓HCl反应制Cl2的实验中,在将生成的Cl2通入NaOH溶液之前,先将Cl2从装置 管口导进,从 管口导出,此时,该装置所起的作用是防止NaOH溶液倒入流入反应器。
(3) 当用此装置收集NO时,应采取的主要操作步骤是:
① ②
②将另一部分红色固体加足量的4摩/升硫酸溶液,轻轻振荡,经足够长的时间以后,溶液呈蓝色,还有相当多的紫红色固体未溶解。
根据上述实验现象回答或填空:
(1) 解释在实验①中产生红棕色气体及溶液变蓝的现象(用简要的文字和化学方程式说明该现象)
(2) 解释实验②中紫红色固体不溶的现象。
(3) 解释实验②中溶液变蓝的原因。
(4) 由上述分析可以得知氧化铜被氢气还原可能分两步进行,写出这两步反应的化学方程式。
3. 有1、2.3、4号四瓶未知溶液,它们是:NaCl(0.1mol/L)、HCl(0.1mol/L)、NaOH(0.1mol/L)、酚酞(0.1%),有人不用其它试剂,就把它们-一鉴别开来了。其实验步骤如下:
(1) 各取少许溶液两两混和,据此分成两组;
(2) 取一组混和液,不断滴入另一组中的一种未知液,据此可鉴别出1号和2号;
(3) 再取已鉴别出的1号2mL,滴入3滴3号未知液,再加4号未知液4mL,在这个过程中无明显实验现象。
综合以上实验,可以确认1号是 ,2号是 ,3号是 ,4号是 。
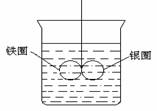 4. 如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入CuSO4溶液。
4. 如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入CuSO4溶液。
(1) 片刻后观察到的现象是(指金属圈)__________.
A. 铁圈和银圈左右摇摆不定
B. 保持平衡状态不变
C. 铁圈向下倾斜
D. 银圈向下倾斜
(2) 产生上述现象的原因是
.
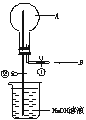 5. 如图所示,在一个烧瓶中充满气体A,打开①处的止水夹并向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。请按要求填表回答打开②处的止水夹前后烧瓶中观察的现象并按要求书写反应的化学方程式:
5. 如图所示,在一个烧瓶中充满气体A,打开①处的止水夹并向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。请按要求填表回答打开②处的止水夹前后烧瓶中观察的现象并按要求书写反应的化学方程式:
(1) 填写下列表格:
|
实验
序号 |
气体A |
气体B |
现 象 |
A与B反应 的化学方程式 |
|
|
打开②处止水夹前 |
打开②处止水夹后 |
||||
|
① |
SO2 |
H2S |
---- |
|
|
|
② |
NH3 |
HCl |
|
|
|
|
③ |
O2 |
NO |
|
|
|
 (2) 分别完成以上三个实验后,烧瓶内剩余气体最多的是(填实验序号) 。
(2) 分别完成以上三个实验后,烧瓶内剩余气体最多的是(填实验序号) 。
1] (1)H2、CO2、H2S H2(若后面方程式写成金属与酸反应,该空格不得分) 2Al+2OH-+2H2O=2AlO2-+3H2↑ (2)①2CO2+2Na2O2=2Na2CO3+O2 ②合理,由于过氧化钠具有强氧化性,能将+4价的硫氧化为+6价的硫而生成硫酸钠。 ③B装置用于干燥SO2气体,防止水蒸气进入C装置与Na2O2反应 D装置是为了防止空气中的水蒸气进入C装置与Na2O2反应生成氧气,同时吸收过量SO2气体,便于氧气的检验和防止污染空气。 ④ABD
1] (1)NaHCO3是从含大量NH4+、Na+、Cl-、HCO3-离子的饱和溶液中析出的,所以NaHCO3晶体中混有杂质,由于NaCl受热时不发生变化,导致工业纯碱中常含有少量的NaCl。
|
分析与计分 |
计算样品中碳酸钠的质量分数 |
对实验结果的评价 |
实验失败的主要原
因及对结果的影响 |
|
甲组 |
84.8% |
失败 |
所生成的CO2没有被全部吸收,有一部分滞留在反应容器中,导致测定结果偏低。 |
|
乙组 |
95.4% |
成功 |
/ |
|
丙组 |
95.4% |
成功 |
/ |
1] 4︰1氨水(或②) KClO3和MnO2的混合物(或④) (2)4NH3+5O2 4NO+6H2O (3)0.5mol/L NaOH溶液和酚酞试液(或⑧、⑨) 红色褪去 (4)安全(或防止液态物质冲出) (5)6mol/LNaOH溶液(或⑦) 吸收氮的氧化物
4NO+6H2O (3)0.5mol/L NaOH溶液和酚酞试液(或⑧、⑨) 红色褪去 (4)安全(或防止液态物质冲出) (5)6mol/LNaOH溶液(或⑦) 吸收氮的氧化物
1] (1)②⑤⑥;③⑥⑦ (2)①先倒入足量的稀H2SO4,倾斜试管,试管内壁放入一定量的锌片(不与酸接触,不能是倒过酸的一边),塞紧塞子,再竖直试管,使锌片落入试管底部。 ②小试管 ③上下移动乙管,使甲、乙两管的液面相平行,并赶走附在液体内壁的小气泡。 使甲管内气压与大气压相等 ④b、c、f;c、d
1] (1)①NO ②a稀硝酸 b铜屑 c蒸馏水 ③乙 ④3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O ⑤铜片与稀硝酸反应,有无色气泡产生;试管a上部空间气体由无色变成红棕色,又变红色;试管a中溶液由无色变蓝色;反应过程中铜片逐渐减小,以至消失。 (2)不正确 依据是:铜片质量相同,生成铜离子的物质的量相同,溶液体积相同且硝酸过量,故生成的Cu2+的浓度相同。 方案及实验现象:将绿色溶液加热,有红棕色气体产生,溶液变成蓝色,说明后一种推断正确。或:将溶液稀释,溶液变蓝色(其它合理方案均可)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com