
题目列表(包括答案和解析)
1. 人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为
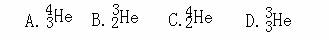
26、有机物X由C、H、O三种元素组成,X的沸点是198℃,已知:①在一定温度和压强下,在密闭容器中把4.2 L X蒸气和16.0 L O2混合点燃,当充分反应后,将温度和压强恢复到原来状况,得混合气体A为26.5 L(已知在该实验状况下气体的摩尔体积为42.0 L·mol-1);②当A处于标准状况下时,气体体积变为7.3 L,此时测得气体对H2的相对密度为19.64。解答下列问题:
(1)推断气体A的组成(简述过程和结论)。
(2)计算A的各组分的物质的量。
25、铅蓄电池在作电源时,用硫酸作为电解质溶液。电池放电时反应如下:Pb+PbO2+2H2SO4==2PbSO4+2H2O。下表是不同质量分数的硫酸对应的密度。
|
质量分数 |
0.220 |
0.252 |
0.283 |
0.314 |
0.344 |
0.374 |
0.403 |
|
密度(g/mL) |
1.155 |
1.180 |
1.205 |
1.230 |
1.255 |
1.280 |
1.305 |
回答下列问题:
(1)写出电池放电时正极的电极反应式:__________________________。
(2)已知铅蓄电池中硫酸溶液的密度低于1.18 g/mL时,将不再放电,此时需要充电;充电过程中,当密度达到1.28 g/mL时,电池自行停止充电。现有某经充分充电后的铅蓄电池(设铅蓄电池的容积为2L,且在充、放电过程中液体体积保持不变),现让该电池充分放电,理论上将释放出多少的电量(以电子数目表示)?
24、D(分子式为C7H9NO2)涂在手术后的伤口上,发生加聚反应,数秒钟后生成E而固化,起到缝合伤口的作用。D可以由一系列反应合成。

A(CH3-CH==CH-COOH)
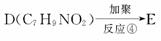

(1)B的结构简式为 。
(2)写出反应类型:反应① ;反应② ;反应③ 。
(3)反应③的化学方程式 。
23、现有下列物质之间的转化关系图:

已知:在上述转化过程中均未引入有机反应物(X除外),而且A的相对分子质量比X大79,而C的相对分子质量又比A大79。试回答下列问题:
(1)B的结构简式为_________________
(2)D和乙二酸在浓硫酸、加热条件下会形成六元环状化合物,试写出反应的化学方程式:___________________________________________________
(3)指出物质转化图中反应(1)、(2)、(3)、(4)依次所属的反应类型:__________________________________________________________________
22、将a mol A(g),d mol D(g)置于体积可变的密闭容器中加热至一定温度,发生如下反应:
2A(g)  2B(g)+C(g),2D(g)+C(g)
2B(g)+C(g),2D(g)+C(g)  2E(g)
2E(g)
t min时建立平衡,平衡时测得B的物质的量为m mol,C的物质的量为n mol,试回答:
(1)平衡时,D的物质的量为 mol(用含d、m、n的代数式表示)
(2)平衡时若温度压强与反应前相同,则反应前和平衡时气体的密度之比为(用含a、d、m、n的代数式表示)
21、A 、B、C、D是分布在三个短周期内除希有气体以外的四种元素,它们的原子序数依次递增。且已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B原子的核外电子数。回答下列问题(必须用对应的元素及其化合物的化学式回答下列问题,如果试题涉及有机物,请写出有机物的结构简式。)
1) 画出元素C的原子结构示意图:___________________________;
2) 由元素D组成的单质,与某一D原子最近的D原子有_________个;
3) BC2的化合物的熔点比DC2______(填“高”或“低”),其原因是_____
_________________________________________________________;
4) 元素A、B形成的化合物有多种。试写出所有的A、B原子在同一平面
的两种化合物_____________________;
5)D与A能形成原子个数比为1:4的化合物。该物质还原性很强,通入盛硝酸银溶液的试管中,会产生银镜,同时生成一种D的氧化物(不溶于水)和硝酸。该反应方程式为____________________________________________。
20、最近报纸上经常刊载有关建筑工人误食亚硝酸钠(由于亚硝酸钠很象氯化钠而误作食盐)中毒的事件,某课外兴趣小组决定开展研究,寻求可行的方法,鉴别某样品是亚硝酸钠还是氯化钠,以解决这一问题。该小组查阅了大量的资料,对亚硝酸钠的性质做如下归纳:
亚硝酸钠,化学式为NaNO2,是亚硝酸(HNO2,一种弱酸)的钠盐。白色粉末,易溶解在水中,有毒,容易潮解。由于亚硝酸钠中的氮元素处于中间价态,既有氧化性(在酸性条件下会氧化KI,得到碘单质),又有还原性(在酸性条件下,会被KMnO4氧化)。大量用于防锈、印染等……
甲设计方案如下:取少量固体,配成溶液。往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色。如果褪去,说明该样品为亚硝酸钠。反应表达式为:
___MnO4-+___NO2-+___H+=___Mn2++___NO3-+___H2O
(1)配平上述离子方程式;
(2)根据上述信息,还可以设计其他一些实验方案。试写出你所设计的方案(注:能写几种写几种;用品自行选择;简要写出实验操作、现象和结论。)
(3)甲认为他的方案还可测定样品中亚硝酸钠的含量。过程如下:Ⅰ、称一定量样品,溶于水置于锥形瓶中;Ⅱ、取酸性KMnO4溶液(过量)倒入锥形瓶中,振荡;Ⅲ、用草酸钠溶液滴定过量的KMnO4;Ⅳ、重复上述操作。
①若每次实验时用到0.10mol/L酸性KMnO4溶液25.00mL,为减小实验误差,从中学的角度看,量取该溶液时宜采用的仪器是______________________。
②各次实验数据如下:
|
实验次序 |
样品质量(g) |
滴定管中的草酸钠溶液(浓度为0.25mol/L) |
|
|
滴定前滴定管读数(mL) |
滴定后滴定管读数(mL) |
||
|
1 |
5.0 |
1.02 |
10.02 |
|
2 |
5.0 |
1.56 |
10.60 |
|
3 |
5.0 |
1.26 |
10.24 |
已知:2MnO4-+5C2O42-+16H+==2Mn2++10CO2↑+8H2O。试计算样品中NaNO2的质量分数(必须列出计算过程;假设该样品只含有NaNO3和NaNO2)。
19、指出下列操作对实验结果的影响。
(1)欲配制0.1 mol·L-1 CuSO4溶液100 mL,取2.5 g胆矾在烧杯中溶解,然后倒入容量瓶定容在100 mL,则浓度偏______________。
(2)用80% H2SO4加等体积水配40% H2SO4,则浓度偏_______________。
用80%酒精加等体积水配40%酒精,则浓度偏_______________。
18、对于xA(g)+yB(g)  zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是( )
zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是( )
A、x+y>z+w,正反应是放热反应
B、x+y>z+w,正反应是吸热反应
C、x+y<z+w,逆反应是放热反应
D、x+y<z+w,逆反应是吸热反应
第Ⅱ卷(非选择题 共78分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com