
题目列表(包括答案和解析)
15.R为短周期元素,其原子所具有的电子层数为最外层电子数的1/2。它可能形成的含氧酸根离子有:①R2O42-、②RO42-、③R2O32-、④RO32-。则下列判断正确的是
A.当它形成①时,不可能形成④ B.当它形成②时,不可能形成③、④
C.当它形成①时,不可能形成②、③ D.当它形成②时,可以形成①
14.把6 mol气体A和5 mol气体B混合后充入4 L密闭容器中在一定条件下反应:3A (g) + B (g) 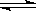 x C (g) + 2 D (g),在5 min时达到平衡,此时生成2 mol D,并测得C的平均速率为0.1 mol /(L•min),则下列结论错误的是
x C (g) + 2 D (g),在5 min时达到平衡,此时生成2 mol D,并测得C的平均速率为0.1 mol /(L•min),则下列结论错误的是
A.x的值为1 B.B的平衡浓度为1.0 mol /L
C.B的转化率为20% D.A的平均速度为0.15 mol / (L•min)
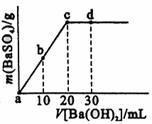
13.常温下,向0.1mol·L-1的硫酸溶液中逐滴加入物
质的量浓度相同的氢氧化钡溶液,生成沉淀的量与
加入氢氧化钡溶液的体积关系如图所示。a、b、c、
d分别表示实验时不同阶段的溶液,下列有关说法中
不正确的是
A.c、d溶液呈碱性 B.溶液的导电能力:a>b>d>c
C.a、b溶液呈酸性 D.溶液的pH:a<b<c<d
12.恒温下,将两个铂电极插入一定量的Na2SO4饱和溶液里进行电解,经过一段时间后,在两极共产生 气体,同时从溶液中析出m g Na2SO4·10H2O晶体,则原Na2SO4
气体,同时从溶液中析出m g Na2SO4·10H2O晶体,则原Na2SO4
饱和溶液的质量分数为
 A.71m/161(m+18n) B.71m/161(m+12n)
A.71m/161(m+18n) B.71m/161(m+12n)
C.71/161(m+36n) D.m/161(m+12n)
11.X、Y为短周期元素,X原子各电子层的电子数之比为1 :4 :1,它比Y原子多3个电子,下列叙述正确的是
A.X离子半径大于Y离子半径 B.X、Y两元素位于同一周期
C.X单质在空气中燃烧可生成两种化合物 D.X、Y形成的化合物是共价化合物
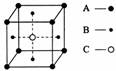
10.某物质的晶体中含有A、B、C三种元素,其排列方式如图所示(其中前后两面面心中的B元素的原子未能画出)。晶体中A、B、C的原子个数比为
A.1∶3∶1 B.2∶3∶1 C.2∶2∶1 D.1∶3∶3
9.下列离子方程式中正确的是
A.氨水中加入明矾溶液:3OH-+Al3+===Al(OH)3↓
B.硫酸铜溶液中加入氢氧化钡溶液:SO42-+Ba2+===BaSO4↓
C.碳酸氢铵溶液中加入足量的氢氧化钠溶液:
NH4++HCO3-+2OH-===NH3·H2O+CO32-+H2O
D.向漂白粉溶液中通入SO2气体:
 Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
8.恒温下的下列实验过程中,有关溶液的浓度和质量始终不变的是
A.向浓氨水中持续通入干燥洁净的空气(不含CO2)
B.向KNO3饱和溶液中加入ngKNO3晶体
C.向98.3%浓H2SO4中加入ngSO3
D.向CuSO4饱和溶液中加入ng无水CuSO4
7.几种酸碱指示剂变色的pH值范围如下:①甲基橙3.1~4.4②甲基红4.4~6.2③酚酞8.2~10。现用0.10mol/LNaOH溶液滴定浓度相近的HCOOH,则上述指示剂
A.都可以用 B.只能用③ C.可以用①或② D.可以用②或③
5.下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中马上泛起白色泡沫
B.实验室常用排饱和食盐水的方法收集氯气
C.工业上生产硫酸的过程中使用过量的空气以提高SO2的利用率
D.合成氨工业使用500℃的高温以提高单位时间的产量
|
|
|
A.NaCl Na+ :Cl: B.HClO H :Cl:O:
|
|
|
|
C.-CH3 H:C : D.NH4I [H : N :H]+I-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com