
题目列表(包括答案和解析)
21. (8分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度远 大于第二步的电离程度,第二步的电离程度远大于第三步电离程度。…… 今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
①HA+HC2-(少量)=A-+H2C-
②H2B(少量)+2A-=B2-+2HA
③H2B(少量)+H2C-=HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是 。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子的是 ,最难结合质子的是 。
(3)判断下列反应的离子方程式中正确的是(填写标号) 。
A.H3C+3A-=3HA+C3- B.HB-+A- =HA+B2- C.H3C+B2-=HB-+H2C-
(4)完成下列反应的离子方程式
A.H3C+OH-(过量):
B.HA(过量)+C3-
20.(8分)已知反应AsO43-+2I-+2H+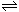 AsO33-
+I2+H2O是可逆反应.现设计如图2-33所示的实验装置,A烧杯中装有Na3AsO4和Na3AsO3溶液,B烧杯中装有I2和KI溶液.两烧杯用一倒置的装有饱和氯化钾的U形管相连,此装置称为盐桥。其作用是避免两烧杯中的电解质溶液相混合,又使两烧杯中的电解质溶液能导电。C1、C2为惰性电极,现进行如下操作:a.向B溶液中滴入浓盐酸,发现电流计指针发生偏转.b.若改向B溶液中滴入40%的氢氧化钠溶液,发现电流计指针向相反方向偏转.试回答下列问题:
AsO33-
+I2+H2O是可逆反应.现设计如图2-33所示的实验装置,A烧杯中装有Na3AsO4和Na3AsO3溶液,B烧杯中装有I2和KI溶液.两烧杯用一倒置的装有饱和氯化钾的U形管相连,此装置称为盐桥。其作用是避免两烧杯中的电解质溶液相混合,又使两烧杯中的电解质溶液能导电。C1、C2为惰性电极,现进行如下操作:a.向B溶液中滴入浓盐酸,发现电流计指针发生偏转.b.若改向B溶液中滴入40%的氢氧化钠溶液,发现电流计指针向相反方向偏转.试回答下列问题:
 (1)电流计指针为什么能发生偏转
(1)电流计指针为什么能发生偏转
。
(2)两次操作中,电流计指针的偏转方向为什么相反?用化学平衡原理解释。
(3)写出a操作中C1棒上和 b操作中C2棒上发生的电极反应方程式。
a操作中C1棒 b操作中C2棒
19.(8分)有A、B、C、D四种元素,它们的原子序数由A至D逐渐增大,D的氢化物分子式为H2D,D在最高价氧化物中质量分数为40%,而且D的原子核内质子数和中子数相等;A和B原子有相同的电子层数。A原子的最外层电子数是次外层电子数的2倍;B的阴离子、C的阳离子和Ne原子的电子层结构相同。通常状况下B的单质是气体,0.1 molB的单质和H2充分反应时,有2.408×1023个电子转移;C的单质在高温下与B的单质充分反应可得淡黄色固体,此生成物与AB2反应可生成B的单质,由以上叙述回答:
(1)C、B单质反应生成的淡黄色固体的电子式为_____________。AB2结构式为 ,分子的空间构型为 , AB2的晶体属于 晶体。
(2)淡黄色固体与AB2反应可生成B的单质的化学方程式为
(3)C和D组成的化合物溶于水,溶液并不显中性的原因是(用离子方程式稀释):
。
18. 某二元弱酸的酸式盐NaHA溶液,若pH<7则溶液中各离子的浓度关系不正确的是
A. c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B. c(Na+)+ c(H+) = c(HA-)+2c(A2-)+ c(OH-)
C. c(H+)+ c(A2-)= c(OH-) + c(H2A)
D. c(Na+)=== c(HA-)+ c(H2A)+ c(A2-)
17.向Cr2(SO4)3的水溶液中,加入NaOH溶液,当pH=4.6时,开始现现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-)。其平衡关系如下:

 Cr3++3OH-
Cr(OH)3 CrO2-+H++H2O
Cr3++3OH-
Cr(OH)3 CrO2-+H++H2O
(紫色) (灰绿色) (亮绿色)
向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入1.0mol·L-1的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
16.下列各选项所述的两个量,前者一定大于后者的是
①F2和Br2的沸点 ②纯水在25℃和80℃时的pH值 ③同温下分别在100g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量 ④25℃时,等体积的pH值都等于3的盐酸和AlCl3溶液中,已电离的水分子数 ⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 ⑥耐火材料MgO和CaO的熔点 ⑦H-和H+离子半径 ⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A.①②④⑥ B.①②③⑤ C.⑤⑥⑦⑧ D.②⑥⑦
15.X、Y、Z为短周期元素,X元素原子核内无中子,Y元素原子核外最外层电子数是次外层电子数的两倍,Z元素是地壳中含量最多的元素,这三种元素可能组成的物质的化学式为
①X2YZ ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3
A.①②③④ B.②⑤ C.②④⑥ D.②⑤⑥
14.VCD光盘上的光记材料有多种,其光记原理为在激光照射下发生物理变化或化学变化从而记录储存信号,碲(Te)的某种化合物是常见的一种VCD光记录材料,下列关于碲及其化合物的叙述不正确的是
A.单质碲是一种银白色的固体 B.元素位于元素周期表中第五周期ⅥA族
C.碲酸的酸性比硫酸强 D.碲化氢不如硫化氢稳定
13.镍的氧化物晶体中,由于n(Ni):n(O)<1,所以晶体结构存在缺陷,通常表示成Ni0.97O。则标明镍价态的该晶体的化学式是
A. B.
B.
C. D.
D.
11.某元素的离子R2+有5个电子层,最外层有2个电子,当RCI2固体配成溶液时,为得到澄清溶液并防止变质,常在溶液中加入少量R单质和盐酸,下列叙述正确的是
A.R为IIA族元素 B.R的最高价氧化物的对应水化物是强碱
C.R2+的硝酸盐水溶液呈中性 D.RCI2有还原性,可进一步被氧化
|
A.用惰性电极电解MgCl2溶液2Cl-+2H2O Cl2↑+H2↑+2OH-
B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:
Ca2++2HCO3-+2OH- CO32-+CaCO3↓+2H2O
C.次氯酸钙溶液中通入过量的CO2:
Ca2++3ClO-+H2O+CO2 CaCO3↓+2HClO
D.氢氧化铁溶于碘化氢溶液:Fe(OH)3+3H+ Fe3++3H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com