
题目列表(包括答案和解析)
6.下列离子中最易给出电子的是( ).
(A)Cl- (B)Cu2+ (C)Fe2+ (D)F-
5.下列物质有固定元素组成的是( ).
(A)空气 (B)石蜡 (C)氨水 (D)二氧化氮气体
4.随着卤素原子半径的增大,下列递变规律正确的是( ).
(A)单质的熔沸点逐渐降低 (B)卤素离子的还原性逐渐增强
(C)气态氢化物稳定性逐渐增强 (D)单质氧化性逐渐增强
3.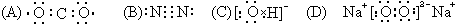 下列电子式书写错误的是( ).
下列电子式书写错误的是( ).
2.下列过程中,共价键被破坏的是( ).
(A)碘升华 (B)溴蒸气被木炭吸附
(C)酒精溶于水 (D)HCl气体溶于水
1.下列物质中,不含结晶水的是( ).
(A)芒硝 (B)大理石 (C)明矾 (D)生石膏
25.(10分)在一定温度下,有1mol N2气体和3mol H2气体发生下列反应:
N2(g)+3H2(g)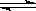 2NH3(g);△H<0
2NH3(g);△H<0
(1)若在相同温度下,分别在1L定压密闭容器中和1L定容容器中反应(密闭):
哪个容器中的反应先达到平衡? 答:
哪个容器中的N2的转化率高? 答:
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5摩氩气,则N2的转化率会起什么变化?正反应速度与原平衡相比,有无变化,简答理由。
(3)若在1升定容容器中,上述反应达到平衡时,平衡混和物中N2、H2、NH3的物质的量分别为A、B、C摩。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3的加入量(mol),应满足的条件是:
①若x=0,y=0,则z= ,
②若x=0.75,则y应为 mol、z应为 mol。
③x、y、z应满足的一般条件是 。
24.(5分)超氧化物歧化酶SOD(本题用E为代号)是生命体中的“清道夫”,在它的催化作用下,生命作代谢过程产生的超氧离子(O2-)才不致过多积存而毒害细胞使人过早衰老。
|
 (1) 超氧离子在催化剂SOD存在下发生了如下反应,请完成该反应的离子方程式:
(1) 超氧离子在催化剂SOD存在下发生了如下反应,请完成该反应的离子方程式:
 _ O2- + _
_ O2 + _ H2 O2
_ O2- + _
_ O2 + _ H2 O2
(2) 含有SOD的浓度为c0 (E)=0.400×10-6 mol/L,pH=9.1溶液中,对该反应进行研究,在常温下测得不同超氧离子的起始浓度c0(O2-)下,超氧化物歧化反应的起始反应速率Vo如下:(mol·L-1·s-1)
|
c0(O2-) (mol/L) |
7.96×10-6 |
3.33×10-5 |
2.00×10-4 |
|
V0 (mol·L-1·s-1) |
3.85×10-3 |
1.67×10-2 |
0.100 |
已知该歧化反应在常温下的速率方程可表示为:Vo =k [c0(O2-)]n。试根据测定数据确定歧化反应的反应级数:
n= ,化学反应速率常数k=_____________。
23.(10分)请用图中的装置设计一个实验以测定SO2转化为SO3的转化率:
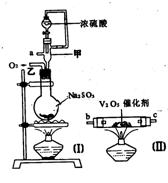
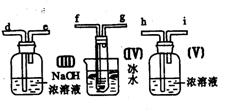
(1)这些装置的连接顺序(按气体从左到右的方向)是____→ ____→__ →_____→____→____→___→____→(填各接口的编号)。
(2)实验时甲装置的作用是________________________________。
(3)从乙处均匀地通入O2,为使SO2有较高的转化率,实验时(Ⅰ)处滴入浓H2SO4与(Ⅱ)处加热催化剂的先后顺序是__________________。
(4)(Ⅳ)处观察到的现象是______________。
(5)在(Ⅰ)处用大火长时间加热烧瓶,SO2的转化率会_____(填“增大”、“减小”或“不变”),试说明原因_________________________。
(6)用n mol Na2SO3粉末与足量浓H2SO4进行此实验,当反应结束时,继续通入O2一段时间后,称得(Ⅲ)处增重m g(假设m g均为未反应的SO2,且SO2无其他损耗),则本实验中的转化率为__________。
22.(5分)已知Ag(NH3)2+不太稳定,在溶液中存在如下的离解平衡:Ag(NH3)2+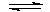 Ag+2NH3,所以需用过量的氨水才能溶解某些含Ag+的沉淀物.今有两份固体混合物A、B,它们分别由Al2(SO4)3、AgCl、AgNO3、BaCl2、NH4Cl、NH4NO3、KOH、Na2S中的两种或三种组成.某同学为确定A、B的组成进行了如下的实验:分别取A、B各少许,各加入适量的蒸馏水充分振荡,都只得无色溶液;分别取无色溶液各少许,各滴加稀硝酸,都有白色沉淀生成.试回答:
Ag+2NH3,所以需用过量的氨水才能溶解某些含Ag+的沉淀物.今有两份固体混合物A、B,它们分别由Al2(SO4)3、AgCl、AgNO3、BaCl2、NH4Cl、NH4NO3、KOH、Na2S中的两种或三种组成.某同学为确定A、B的组成进行了如下的实验:分别取A、B各少许,各加入适量的蒸馏水充分振荡,都只得无色溶液;分别取无色溶液各少许,各滴加稀硝酸,都有白色沉淀生成.试回答:
(1)A、B的可能的组合是什么?
(2)试设计实验继续确证A、B的组成,简述有关的操作、现象和结论.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com