
题目列表(包括答案和解析)
25、C 26、A 27、B 28、C 29、A D
19、A 20、C 21、A 22、D 23、C 24、A
13、B C 14、D 15、D 16、D 17、A 18、B
7、A C 8、B D 9、D 10、A D 11、B 12、A B
3、两种金属混合物5.4g,这两种金属,在化合物中表现出的价数为+2、+3,该混合物用盐酸处理时放出10.08LH2(标况),已知一种元素的原子量是另一种元素的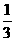 ,在混合物中两者物质的量之比为3:1,试计算确定所取的是哪两种金属?
,在混合物中两者物质的量之比为3:1,试计算确定所取的是哪两种金属?
[《酸、碱、盐》综合练习答案]
2、质量为23.24g的粉末,它是由NaCl、CuSO4、Na2O2、K2CO3、(NH4)2SO4、Na2SO4、K2SO4、等物质中某几种混合而成。
(1)将粉末全部投入水中得无色溶液和气体,加热使之完全反应,共得干燥气体3.36L(标况);(2)将所得溶液分成两等份,一份滴入酚酞呈红色,用4mol·L-1盐酸中和,用去12.5mL;另一份加NHO3酸化,无气体产生,加足量Ba(NO3)2溶液得到白色沉淀12.815g,滤液加AgNO3无明显现象。(3)所得3.36L气体通过浓H2SO4体积明显减小,再通过碱石灰,体积不变,根据以上现象和数据确定粉末由哪些物质组成?质量各为多少克?
1、一定质量的KClO3和MnO2混合物加热至无气体产生时,将残余的固体与足量的浓H2SO4共热,固体全部溶解,并把此时生成的气体通入500mL某浓度的Na2SO3溶液中,设气体全部被吸收且无气体逸出,溶液中亦无Cl2分子存在,测得溶液PH值为零(不计溶液体积变化)最后向溶液中加入足量BaCl2溶液,生成不溶于酸的白色沉淀16.31g,求原混合物中KClO3和MnO2的质量及Na2CO3的物质的量浓度。
2、下列各组中的两反应是否矛盾?指出你的依据?
(1)Cl2+2KBr=2KCl+Br2 Br2+2KClO3=Cl2+2KBrO3
|

 (3)SiO2+Na2CO3
Na2SiO3+CO2↑ CO2+2H2O+Na2SiO3=H4SiO4↓+Na2CO3
(3)SiO2+Na2CO3
Na2SiO3+CO2↑ CO2+2H2O+Na2SiO3=H4SiO4↓+Na2CO3
1、工业上用银与浓HNO3反应来制取硝酸银,在实际生产中要把购进的浓HNO3加入等体积水稀释后,再在加热条件下跟Ag反应制AgNO3。试简要回答:
(1)为什么不用浓HNO3制AgNO3?
(2)反应完毕后,为除去杂质Fe3+,为何调整PH值为4后再通入过量水蒸气?
(3)欲制得AgNO3晶体应采用什么方法?
(4)尾气如何处理?
14、用两根铂丝做电极插入KOH溶液中,再向两个电极上分别通甲烷和氧气可形成原电池--从而设计出一种燃料电池,写出电极反应式和总反应式。
负极_________________、正极_________________.
总反应式__________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com