
题目列表(包括答案和解析)
4、 300C时,不饱和Na2SO3溶液加20g无水Na2SO3或加入50g Na2SO3·2H2O均达到饱和,
求Na2SO3溶解度.
3、 t0C,一包白色CuSO4粉未放入150g水中,形成84g溶液,t0CS 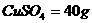 ,求包
,求包
CuSO4的质量.
2、浓H2SO4吸收SO3后得到的SO3溶于纯H2SO4的溶液称为发烟硫酸,现有1L含SO3为30%的发烟H2SO4(ρ=1.95g·cm-3),需加入多少升水可稀释为95%的H2SO4?
1、(1)电解食盐用的盐水中含Ca2+30ppm,问这样的盐水1×103kg,需加多少千克Na2CO3才能把Ca2+除去?
(2)已知200C时有[Ca2+][CO32-]=8×10-9,当[Ca2+]≤1×10-5mo ·L-1时,可看作Ca2+沉淀完全,欲使该盐水中Ca2+沉淀完全,求加入0.1mo
·L-1时,可看作Ca2+沉淀完全,欲使该盐水中Ca2+沉淀完全,求加入0.1mo ·L-1Na2CO3溶液的最小体积(假设此时盐水的密度为1g·cm-3)
·L-1Na2CO3溶液的最小体积(假设此时盐水的密度为1g·cm-3)
8、用Na2SO3和S粉在水溶液中加热反应,可制得Na2S2O3.100C和700C时,Na2S2O3在100g水中分别最多溶解60.0g和212g.常温下从溶液中析出的晶体是Na2S2O3·5H2O. Na2S2O3在酸性溶液中立即完全分解:Na2S2O3+2HC =S↓+SO2↑+H2O+2NaC
=S↓+SO2↑+H2O+2NaC ;现出15.1gNa2SO3溶于80mL水,另取5.00g硫粉用少许乙醇润湿后(以便硫能被水润湿)加到上述溶液中,用小火加热至微沸,反应约1小时后过滤,滤液在1000C经蒸发浓缩冷却至100C后,析出Na2S2O3·5H2O晶体
;现出15.1gNa2SO3溶于80mL水,另取5.00g硫粉用少许乙醇润湿后(以便硫能被水润湿)加到上述溶液中,用小火加热至微沸,反应约1小时后过滤,滤液在1000C经蒸发浓缩冷却至100C后,析出Na2S2O3·5H2O晶体
(1)若加入的S粉不用乙醇润湿,对反应的影响是
A、会降低反应速率 B、需要提高反应速率 C、增大反应体系PH值 D、会减少产量
(2)反应1小时后过滤,其目的是
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 ,
它是由 而产生的,如果滤液中该杂质的含量不很低,其检测方法是
(4)设Na2SO3跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至700C,溶液的体积约为
30mL,该溶液是否达到饱和? .试通过计算说明(700C时Na2S2O3饱和溶液的密度为1.17g·cm-3)
(5)若要计算在1000C时将溶液蒸发至体积为30.0mL,再冷却到100C时,所得到的Na2S2O3·5H2O的质量,你认为 .(填写一个选项字母)
A、前面提供的数据已足够
B、还需要提供1000C时溶液的密度(1.14·cm-3)
C、还需要提供结晶后剩余溶液的体积(10.0mL)
(6)根据第(5)小题你的选择(若选A则直接计算,若选B或C则可选用其数据),计算从100C,30mL溶液中结晶而析出的Na2S2O3·5H2O的质量 .
7、某固体混合物中含有Na+、Fe2+、A 3+和C
3+和C -、Br-.(1)欲将上述所有离子(包括阴、阳离子)分离开来,有以下方法和步骤供选择(其中有的步骤可重复)①溶于水制成稀溶液;②向滤液中通入足量CO2③用CC
-、Br-.(1)欲将上述所有离子(包括阴、阳离子)分离开来,有以下方法和步骤供选择(其中有的步骤可重复)①溶于水制成稀溶液;②向滤液中通入足量CO2③用CC 4萃取④向溶液中加入足量氯水⑤过滤⑥向分离后的溶液中加足量NaOH.
4萃取④向溶液中加入足量氯水⑤过滤⑥向分离后的溶液中加足量NaOH.
最合理的方法和步骤的编号按先后顺序是
(2)分离后最终剩余的水溶液中所含物质是
6、ZnC 2固体中含有Fe3+、Fe2+、Cu2+、Hg2+和Br-等杂质试用最简单的方法除去其杂质.实验步骤为:第一步将固体溶于水,加入 ,再过滤,可除去 离子.第二步向
2固体中含有Fe3+、Fe2+、Cu2+、Hg2+和Br-等杂质试用最简单的方法除去其杂质.实验步骤为:第一步将固体溶于水,加入 ,再过滤,可除去 离子.第二步向
5、往某BaC 2溶液中逐滴加入密度为1.28g·mL-1的H2SO4溶液使其恰好完全反应时,过滤测得滤液的质量与BaC
2溶液中逐滴加入密度为1.28g·mL-1的H2SO4溶液使其恰好完全反应时,过滤测得滤液的质量与BaC 2溶液的质量相等,则此硫酸的物质的量浓度为
2溶液的质量相等,则此硫酸的物质的量浓度为
3、(1)把Wg无水FeSO4溶液配成1mL溶液,测得密度为ρ1,那么其物质的量浓度为
,质量分数为
(2)把Wg无水FeSO4溶于VmL水配成溶液,测得密度为ρ2,求其物质的量浓度为
,质量分数为
(3)把WgFeSO4·7H2O溶于VmL水配成溶液,密度为ρ3,则其物质的量浓度为 ,质量分数为 .
(4)已知98%的浓硫酸物质的量浓度为18.4mo ·L-1,试判断49%的硫酸物质的量浓度 9·2mo
·L-1,试判断49%的硫酸物质的量浓度 9·2mo ·L-1(填>、<或=),通过计算和叙述说明判断的依据
·L-1(填>、<或=),通过计算和叙述说明判断的依据
2、提纯下列各组物质,括号内为杂质,填写合适的试剂及方法.
|
混合物 |
加入试
剂 |
分离方法 |
混合物 |
加入试
剂 |
分离方法 |
C 2(HC 2(HC ) ) |
|
|
C2H5OH(CH3COOH) |
|
|
|
CO2(SO2) |
|
|
FeC 2(FeC 2(FeC 3) 3) |
|
|
|
H2S(HBr) |
|
|
Fe2O3(A 2O3) 2O3) |
|
|
|
Na2O2(Na2O) |
|
|
溴苯(溴) |
|
|
|
HNO3(H2SO4) |
|
|
Na2SO4(NH4C ) ) |
|
|
|
K2CO3(KHCO3) |
|
|
NO(NO2) |
|
|
|
SO2(SO3) |
|
|
CH3COOC2H5(乙酸) |
|
|
|
C2H4(SO2) |
|
|
C2H2(H2S) |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com