
题目列表(包括答案和解析)
7.将3.48gFe3O4完全溶于100mLH2SO4中,然后加入K2Cr2O7溶液25mL,恰好使Fe2+全部氧化为Fe3+,Cr2O7 2-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度为(单位:mol·L-1)
A、0.3 B、0.2 C、0.1 D、0.05
6.W g下列各组物质在足量的O2中充分燃烧,其燃烧产物立即与过量的固体充分反应,固体增重也为W g,符合此要求的是:①H2②CO③H2、CO混合气④CH3COOH⑤C6H12O6
A. ①② B. ④⑤ C. ①②③ D. ①②③④⑤
5.下列关于碱金属的某些性质的排序中,正确的是:
A.原子半径:Li<Na<K<Rb<Cs B.密度: Li<Na<K<Rb<Cs
C.熔、沸点: Li<Na<K<Rb<Cs D.还原性: Li>Na>K>Rb>Cs
4.为了除去酸性AlCl3溶液的Cu2+,下列实验步骤顺序和试剂都正确的是:
①通入CO2气体②加盐酸③加过量NaOH溶液④加入AlCl3溶液⑤过滤
A. ③⑤①⑤② B.③⑤② C. ③⑤①② D. ③⑤④②
3.下列叙述中正确的是:
A.CO2水溶液的导电性较差,故CO2属于弱电解质 B.BaSO4难溶于水,属于非电解质
C.强电解质比弱电解质的水溶液导电能力强
D.向较浓的醋酸溶液中逐滴加入浓氨水,电导实验显示混合溶液的导电能力开始有一个由弱到强的变化过程
2.下列说法中不正确的是
①质子数相同的微粒一定属于同种元素②同位素的性质几乎完全相同③质子数相同,电子数也相同的微粒,不可能是一种分子和一种离子④电子数相同的微粒不一定是同一种元素⑤一种元素只能有一种质量数⑥某种元素的相对原子质量取整数,就是其质量数
A、①②④⑤ B、①②⑤⑥ C、②③⑤⑥ D、③④⑤⑥
1.美国科学家发现C60是一种新的分子,它具有空心的类似足球的结构,被称为“分子足球”。最近日本科学家确认世界上还存在着另一种“分子足球N60”,它与C60的结构相似,并且在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。对于N60,下列说法中正确的是
A.N60是由共价键构成的空心圆球面结构,所以它是一种原子晶体
B.N60和14N都是氮的同位素 C.N60没有同素异形体
D.N60的发现开辟了能源世界新天地,将来会成为最好的火箭燃料
20.A、B、C、D、E、F为原子序数依次增大的主族元素。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3。回答:(1)写出下列元素的符号:A________、D________、E________;
(2)用电子式写出B、F形成的化合物的电子式___________________;(3)A、C两种元素最高价氧化物的水化物反应的离子方程式为__________________________;(4)D的固态氧化物是_______晶体,含n molD的氧化物的晶体中含D-O共价键为_______mol。
19.现有A、B、C三种物质,A为气态氢化物,分子式为RH3,含R为82.4%,B是另一气态氢化物,A+B→C,C与碱液共热放出A。C的水溶液加入稀HNO3酸化后,滴入AgNO3溶液,产生不溶性的白色沉淀,回答下列问题:
(1)写出A的名称和电子式,并指出它是否是极性分子?其稳定性比PH3、H2O如何?
(2)写出B的名称和电子式,并指出它是否是极性分子?其稳定性比HF、H2S、HBr如何?其水溶液的酸性比HF、HBr、H2S如何?
(3)写出C的名称和电子式,具体指明C物质中各部分的化学键,指出C形成的晶体类型。
(4)写出上述有关的化学方程式或离子方程式。
18.晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。NaCl晶体结构如图4-8所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为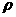 g/cm3,晶胞边长为4.28×10-10m。
g/cm3,晶胞边长为4.28×10-10m。
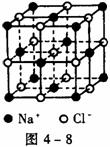
(1)FexO中x值(精确至0.01)为________。
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为________。
(3)此晶体化学式为________。
(4)与某个Fe2+(或Fe3+)距离最近且等距离的O2-围成的空间几何构型形状是______。
(5)在晶体中,铁元素的离子间最短距离为________m。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com