
题目列表(包括答案和解析)
2.下列萃取与分液结合进行的操作(用CCl4为萃取剂从碘水中萃取碘)中错误的是
A.饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中溶液分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器承接并保存上层液体
1、环境问题关系到人类的生存和发展,保护环境就是保护人类自己。从保护环境的角度出发,目前最有发展前景的一次性餐具是
A.瓷器餐具 B.塑料餐具
C.淀粉餐具 D.不锈钢餐具
22、硫酸银溶解度较小,25oC时,每100g水仅溶解0.836g硫酸银。
(1) 25oC时,在烧杯中放入6.24g硫酸银固体,加入200g水,经充分溶解后,所得饱和溶液的体积为200mL。计算溶液中Ag+的物质的量浓度是多少?
(2) 若在上述烧杯中加入50mL 0.0268 mol/L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少升0.0268 mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol/L?
21、(8分)已知水是由H、O元素组成的,用H2还原CuO的实验可证明水中H、O两元素的质量比。具体方法是从CuO的失氧和无水CaCl2吸收水分后的增重计算得出结论。可供选用的仪器如下:
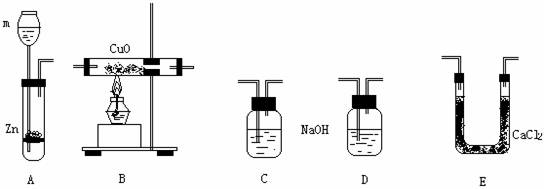
(1)m中盛放的试剂是 。装置D中盛放的试剂是 。C、D的作用分别是: 。
(2)为了准确测出水中H、O两元素质量比,实验装置的连接顺序是:
(3)若用a表示反应前B+CuO质量,b表示反应后B+CuO质量,c表示反应前E+CaCl2质量,d表示反应后E+CaCl2质量,则用数学表达式表示H2O中H、O两元素的质量比为: 。
(4)若通入的H2过量而CuO不足,对此实验结果的影响是 (H、O元素质量比值偏大,偏小,无影响)。
20、(7分)实验室配制500mL 0.2mol/L 的FeSO4溶液,实验操作有如下步骤:
①在天平上称出27.8g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解.
②把制得的溶液小心地注入500mL 容量瓶中。③继续向容量瓶中加蒸馏水至液面距刻度2-3cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。④用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。⑤将容量瓶塞塞紧,充分摇匀。请填写下列空白:
(1)操作步骤和正确顺序(填序号) 。
(2)本实验用到的基本仪器有: 。
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响? (填“偏高,偏低,或不变”)。
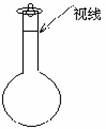
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会 ,加蒸馏水时不慎超过了刻度,会
(5)若实验过程中出现如下情况应如何外理?加蒸馏水时不慎超过了刻度,应
,向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,应 。
19、(6分)在一定温度下,可逆反应2A===B+D达到化学平衡时,反应物与产物的平
|
|
 衡浓度存在如下关系:K=
,K为平衡常数,它只与温度
衡浓度存在如下关系:K=
,K为平衡常数,它只与温度
有关,与浓度,压强,催化剂等条件无关。该反应在四种不同条件下进行,B、D的起始浓度为零。反应物的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
|
实验序号 |
 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800OC |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800OC |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800OC |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820OC |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上表完成下列填充:
(1)在实验1,反应在10至20分钟时间内平均反应速率为 mol/(L·min).
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1 (填“>”,“<”,“=”),且C3的浓度为
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热,或放热”),理由是 。
18、某无色溶液,其中可能存在Na+,Ag+,Ba2+,Al3+,AlO2-,S2-,CO32-,SO32-,SO42-;取该溶液进行有关实验,实验结果如下图所示:
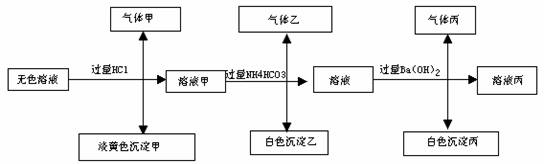
请回答下列问题:
(1)、生成沉淀甲的离子方程式:
(2)、由溶液甲生成沉淀乙的离子方程式:
(3)、沉淀丙可能是: ,如何鉴别其化学成份
(4)、综上信息,该溶液中肯定存在的离子有: 。
17、(6分)A、B、C、D为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成一种极易溶于水的酸性气体Y。X分子与B2A分子中的电子数相同,Y分子中的电子数为18,A、B、D形成离子化合物B4A3D2,其水溶液呈弱酸性。请回答:
(1)元素符号:A B C D
(2)写出化学方程式:C2和X(过量)反应:
(3)B4A3D2的化学式为: ,其水溶液呈酸性的离子方程式
是:
(4)液态X能电离(可根据B2A电离推知),其阴离子的电子式为: 。
16、(9分)(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,写出发生反应的离子方程式: ;在以上中性溶液中,继续滴加Ba(OH)2溶液,写出此步反应的离子方程式: 。
(2)向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀时为止,写出反应的离子方程式: ;在以上溶液中,继续滴加NaHSO4溶液,写出此反应的离子方程式: 。
(3)向Ba(OH)2溶液中,逐滴加入明矾溶液至溶液中Ba2+恰好完全沉淀,其反应的离子方程式为: ;在上述溶液中,继续滴加明矾溶液,请写出此反应的离子方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com